Спектры щелочных металлов
Эти спектры похожи на спектр испускания атома водорода, но только качественно. Наблюдается несколько серий линий и наиболее интенсивные из них получили названия на основе наблюдаемых экспериментально особенностей:
резкая (sharp) – линии этой серии выглядели очень четкими и узкими.
главная (principal) – линии этой серии наблюдались и в спектрах поглощения и спектрах испускания, что указывало, что они соответствуют переходу атомав в основное состояние;
размытая (diffuse) – линии этой серии выглядели размытыми, нечеткими;
основная (fundamental) – линии этой серии напоминали серии линий атома водорода.
Установлено, что рассмотренные серии линий связаны с переходами внешнего (валентного) или оптического электрона.
Система энергетических уровней, соответствующих испусканию указанных линий для атома натрия имеет вид, приблизительно показанный на рисунке 35.3.
 В отличие от атома водорода, энергия состояния оказывается зависящей не только от значения квантового числа n, но и от номера ряда термов. Ряды термов, как и в атоме водорода соответствуют различным значениям азимутального квантового числа l.
В отличие от атома водорода, энергия состояния оказывается зависящей не только от значения квантового числа n, но и от номера ряда термов. Ряды термов, как и в атоме водорода соответствуют различным значениям азимутального квантового числа l.
Эти выводы соответствуют результатам квантовомеханических расчетов – решению уравнения Шредингера для электрона, движущегося в центрально-симметричномнекулоновском поле. Поле ядра в атомах щелочных металлов частично экранируется электронами внутренних электронных оболочек атомов. При этом поле сохраняет сферическую симметрию, но от от расстояния до ядра изменяется по закону, отличному от закона Кулона. В таком поле энергия электрона оказывается зависящей от квантового числа:  Об этом принято говорить, что снимается вырождение по азимутальному квантовому числа
Об этом принято говорить, что снимается вырождение по азимутальному квантовому числа 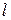 . Однако, в основном энергия зависит все же от главного квантового числа n.
. Однако, в основном энергия зависит все же от главного квантового числа n.
Установлено, что момент импульса атомного остатка щелочных атомов после удаления оптического электрона равен нулю. Следовательно, азимутальное квантовое число L результирующего момента импульса атома совпадает с азимутальным квантовым числом валентного электрона. При возбуждении атома (т.е. при переводе некоторым воздействием из состояния с минимальной энергией в состояние с большей энергией) и при испускании им света изменяется состояние только валентного электрона, поэтому схема уровней атома тождественна схеме уравнения валентного электрона.
Термы, отвечающие столбцам уровней, на схеме энергетических уровней можно обозначить символами nS, nP, nD и nF. Тогда частоты спектральных линий, равные разности термов конечного и начального состояний можно представить в следующем виде:
резкая 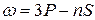 ,
,
главная 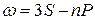 ,
,
диффузная  ,
,
основная 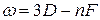 .
.
Ридберг установил, термы щелочных металлов можно представить в виде:
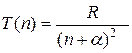 (35.11)
(35.11)
где 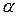 - ридберговская поправка (имеется ввиду поправка в сравнении с термами атома водорода).
- ридберговская поправка (имеется ввиду поправка в сравнении с термами атома водорода).
Эта поправка одинакова для всех термов данного ряда (с данным азимутальным квантовым числом) и обозначается буквой соответствующей ряду.
Соответственно для резкой серии можно записать:
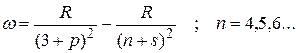
Следуя этому правилу частоты линий серий атома натрия можно представить в виде:
резкая 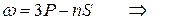
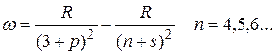
главная 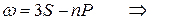
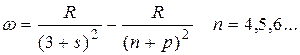
диффузная 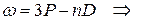
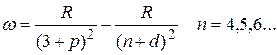
основная 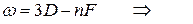
Дата добавления: 2021-01-11; просмотров: 206;










