Уравнение состояния
Для определения многих физических свойств природных газов используется уравнение состояния.
Уравнением состояния называется аналитическая зависимость между параметрами, описывающими изменение состояние вещества. В качестве таких параметров используются давление, температура, объём.Состояние газа при нормальных и стандартных условиях описывается уравнением Менделеева–Клапейрона:
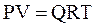 , (2.17)
, (2.17)
где Р – абсолютное давление, Па;
V – объём, м3;
Q – количество вещества, моль;
Т – абсолютная температура, К;
R – универсальная газовая постоянная, Па×м3/(моль×град).
На основе уравнения состояния газа можно рассчитывать многие параметры нефтяного газа: плотность, мольный объём, количество молекул, число молекул, парциальные давления и другие, если рассматривать количество вещества в уравнении состояния газа (2.17), равное 1 молю (Q = 1 моль).
С учётом этого, уравнение состояния газа можно преобразовать следующим образом:
Р·V = ∑N·R·T. (2.18)
Если сумма молей равна единице (∑N = 1 моль), следует, что уравнение приобретает вид Þ Р·V = R·T.
Зная, что масса (m) одного моля идеального газа равна его молекулярной массе (М), умножив левую и правую части на молекулярную массу и массу газа, соответственно, получим:
Р·V·M = m·R·T. (2.19)
Поделив обе части на V·R·T и преобразовав (2.19), получим выражение для расчёта плотности:
Р·M/R·T = m/V, m/V = M·Р/R·T, r = M·Р/R·T. (2.20)
Рассмотрим пример.
Дан один моль метана CH4.
Найти: какова будет плотность метана при н.у. и с.у.?
Решение. Зная, что молекулярная масса метана равна 16,04 г/моль и один моль метана занимает объём при н.у. 22,414 л, а при с.у. 24,055 л, находим:
rCH4 (н.у.) = 16,04/22,414 = 0,716 (г/л);
rCH4 (с.у.) = 16,04/24,055 = 0,665 (г/л).
Из выражения (2.20) и расчётов следует, что плотность газа с возрастанием давления будет расти, а с возрастанием температуры уменьшаться.
Плотность смеси газовых компонентов рассчитывают с учётом средней молекулярной массы смеси газа (Mсм) как отношение молекулярной массы смеси газа к его мольному объёму (Vм).
Например, для нормальных условий плотность газа будет рассчитываться по выражению:
rсм = Mсм /22,414. (2.21)
Если плотность газа (ρо) задана при атмосферном давлении, равном 0,1013 МПа, то пересчёт её величины с учётом другого давления (Р) при той же температуре для идеального газа выполняется по формуле:
r = rо∙Р/Ратм. (2.22)
Рассмотрим другой пример.
Плотность метана при н.у. равна 0,716кг/м3. Определить плотность метана (СН4) при избыточном давлении, например при давлении 500 кПа и температуре 0 °С.
Решение. В этом случае общее давление (1 атм = 101,325 кПа) в системе будет равно Р = (500 + 101,325) = 601,325 кПа.
Зная, что молекулярная масса метана = 16,04 г/моль (кг/кмоль), универсальная газовая постоянная (R) = 8,314 Дж/(К·моль), температура (T) = 273,15 К, находим плотность метана по (2.20 и 2.22):
rCH4 = Р·М/R·T = 601,325·16,04/8,314·273,15 = 4,25 (кг/м3),
rCH4 = rо·Р/Рат = 0,716·601,325/101,325 = 4,25 (кг/м3).
Относительная плотность газов величина, рассчитанная по отношению к плотности воздуха, определенного при тех же условиях:
rосм = rсм /rвозд. (2.23)
Плотность воздуха (ρвозд) при н.у. равна » 1,293 кг/м3, а при с.у. » 1,189 кг/м3.
Рассмотрим пример.
Для условий задачи, рассмотренной выше (пример раздела 2.2), рассчитать абсолютные (r) и относительные (ρосм) плотности смеси газов, используя правое выражение (2.12) для расчета молекулярной массы (г/моль):
Мсм = 100/(36,5/16 +17,2/30 +19,8/44 +14,7/58 +11,8/72) = 26,874;
rсм = 26,874/22,414 = 1,119 (кг/м3);
ρосм (н.у.) = 1,119/1,293 = 0,927.
Аналогично из (2.20) находится и выражение для мольного объёма:
V = R·T/Р. (2.24)
Мольный объём при давлениях, равных или близких атмосферному и, для физических процессов, когда не происходит изменения числа молей в системе, оценивается соотношением:
V = R·T, (2.25)
где R – универсальна газовая постоянная;
Т – температура, К.
Рассмотрим пример.
Найти вид зависимости изменения мольного объёма газа от температуры → V = f(T).
Решение. Воспользуемся выражением (2.25) и получим объём, занимаемый одним молем идеального газа для условий задачи:
Vн.у. = 0,08206·273,15 = 22,414 (м3,);
Vс.у. = 0,08206·293,15 = 24,055 (м3).
Любой газ при н.у. (Т = 0 оС и Р = 100 кПа, 760 мм рт. ст.) занимает объём, равный 22,414 м3, а при с.у. (Т = 20 оС и Р = 100 кПа) занимает объём равен 24,055 м3.
С увеличением температуры мольный объём газа увеличивается. Мольный объём газов с возрастанием температуры будет расти, а с возрастанием давления уменьшаться(2.24).
У этого уравнения есть свои граничные условия. Оно справедливо для описания поведения газов при давлениях, близких к атмосферному (от 0,1 до 1,0–1,2 МПа), и при температурах ≈ 0–20 оС. При повышенном давлении газ сжимается и его состояние отличается от поведения идеальных газов.
Дата добавления: 2019-02-08; просмотров: 711;










