Углеводородных газов
Как отмечалось выше, в нефтяной газ при нормальных и стандартных условиях входят углеводороды от С1 до С4: метан, этан, пропан, изобутан и н-бутан.
С точки зрения строения все они линейно построены, а потому это, так называемые, неполярные углеводороды.
С точки зрения химии, если в системе силами взаимодействия между молекулами можно пренебречь, то такую систему можно рассматривать как идеальную.
К газообразным углеводородам с точки зрения физикиможно применять законы для идеальных систем.
С точки зрения термодинамики идеальным называется газ, внутренняя энергия которого зависит только от температуры и для которого справедливы равенства:
(∂Е/∂V)T = 0, z = Р·V/Q·R·T = 1, (2.4)
где Е – внутренняя энергия парообразования, Дж/моль;
z – коэффициент, характеризующий степень отклонения реального газа от закона идеального газа.
С точки зрения математики к расчёту физико-химических свойств газа, как многокомпонентной смеси можно применять принцип аддитивности.
Аддитивный подход к расчёту физико-химических и технологических параметров означает, что каждый компонент газа в смеси ведёт себя так, как если бы он в данной смеси был один.
Следовательно, для оценки макроскопических свойств нефтяного газа (при н.у. и с.у.) применимы аддитивные методы расчётов физико-химических и технологических параметров (Псмеси):
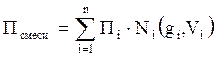 , (2.5)
, (2.5)
где Ni – мольная доля;
gi – весовая доля;
Vi – объёмная доля;
Пi – физико-химическое свойство i-го компонента.
Для идеальных газов общее давление в системе (смеси газов) равно сумме парциальных давлений компонентов (закон Дальтона):
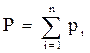 , (2.6)
, (2.6)
где Р – общее давление смеси газов;
рi – парциальное давление i-го компонента в смеси.
Откуда
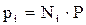 , (2.7)
, (2.7)
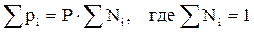 . (2.8)
. (2.8)
То есть, парциальное давление компонента в газовой смеси равно произведению его молярной доли на общее давление смеси газов.
Аддитивность парциальных объёмов (Vi) компонентов газовой смеси выражается законом Амага:
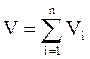 , (2.9)
, (2.9)
где V – общий объём смеси газов;
Vi – мольный объём i-го компонента газа в смеси.
По аналогии с уравнениями (2.7–2.8) мольный объём компонента в газе можно оценить:
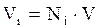 . (2.10)
. (2.10)
Как аддитивные величины рассчитывают все физико-химические свойства газа, например, плотностьсмеси газов:
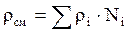 , (2.11)
, (2.11)
где ρi – плотность i–го компонента;
Ni – мольная доля i–го компонента.
Молекулярная масса смеси газовых компонентов рассчитывается по принципу аддитивности по выражению (2.12, левое выражение) для смесей, состав которых выражен в мольных или объёмных долях. Для смесей, состав которых выражен в массовых процентах по (2.12, правое выражение):
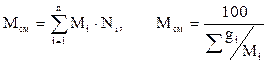 [u2] . (2.12)
[u2] . (2.12)
Рассмотрим пример. При приготовлении рекомбинированной пробы смешивают следующие объёмы (V) газов: 100 м3 пропана (C3H8), 75 м3 изобутана (i-С4Н10) и 75 м3 нормального бутана (n-С4Н10).
Дано: Vi, м3 Mi, г/моль
C3H8 100 44
i-C4H10 75 58
n-C4H10 75 58
Найти: чему равна молекулярная масса смеси газов (Мсм)?
Решение. Находим общий объём газовой смеси 100 + 75 + 75 = 250 (м3), и рассчитываем её объёмный состав в процентах:
250 м3 – 100 %,
100 м3 – Х %;
Х = 100·100/250 = 40 (%) или VC3H8 = 0,4 (в долях);
Аналогично, для → i-C4H10 – X % Þ
X = 75·100/250 = Vi-C4H10 = 30 % = 0,3 (в долях);
для → n-C4H10 – 30 % Þ Vn-C4H10 = 30 % = 0,3 (в долях).
Зная молекулярные массы газовых компонентов смеси (C3H8 → 44; C4H10 → 56) и, что Vi = Ni, рассчитываем величину молекулярной массы смеси газа (Mсм):
Mсм = SMi·Ni = 44·0,4 + 58·0,3 + 58·0,3 = 17,6 + 17,4·2 = 52,4 (г/моль).
Дата добавления: 2019-02-08; просмотров: 572;










