РЕНТГЕНОВСКИЕ ЛУЧИ. СТРОЕНИЕ СЛОЖНЫХ АТОМОВ.
Рентгеновские лучи открыты нем. физиком Рентгеном в 1895г. Дальнейшие исследования рентгеновских лучей в области длин волн 0,01<λ<800 Å позволили выявить два вида рентгеновских излучения : тормозное и характеристическое.
СВОЙСТВА ТОРМОЗНОГО ИЗЛУЧЕНИЯ.

1. Тормозное излучение является электромагнитным излучением с малой длиной волны , которое возникает при резком торможении электронов на материале анода, причем интенсивность этого излучения пропорционально четвертой степени ускорения электрона.
2. Распределение энергии в зависимости от длины волны описывается непрерывной функцией , полученной в рамках электромагнитной теории.
J(λ)=Jە (3с²z/λ max λ³)(λ-½ λ max ) (1)
с- скорость света
z- порядковый номер элемента анода
λ max - длина волны , на которую приходится максимум излучения

3. Существует некоторая граничная частота или длина волны , не зависящая от материала анода и определяется только ускоряющим потенциалом , причем
ν гр ~U (2)
объясняется в рамка теории Эйнштейна , согласно которой энергия приобретенная электроном пройдя разность потенциалов q расходится на энергию излучения квантора hν и энергию ,которую передают электроны атомом пластинки анода , т. е.
eU=hν+Т (3)
Таким образом должна существовать граничная энергия при t=0.
ν гр =eU/h (4)
Ценность уравнения (4) – экспериментальное определение постоянной Планка.
4. Существует длина волны , при которой интенсивность рентгеновского излучения максимальна и согласно уравнению (1)
λ max = 3/2 λ гр (5)
СВОЙСТВА ХАРАКТЕРИСТИЧЕСКОГО ИЗЛУЧЕНИЯ
При некотором критичном напряжении между катодом и анодом на фоне непрерывного
тормозного спектра появляются резкие линии излучения с характерным расположением.
1. Линии спектра излучения являются однозначной характеристикой элемента , составляющего анод. Причем расположение линии не зависит от вида химического соединения , входящего в материал анода.
2. Спектральные линии образуют закономерные последовательности или спектральные серии. Самая коротковолновая серия называется К-серия . Существуют еще и L, M, N, O,...-серии .Отличительной особенностью серии является малое число линий , расположенных однотипно в зависимости от порядкового номера элемента .Английский физик Мозли(1913) обнаружил : Корень квадратный из волновых чисел одной и той же серии прямопропорционален заряду ядра элемента или его порядковому номеру , т. е.

 √2π/λ = √ω ≈ z – закон Мозли (6)
√2π/λ = √ω ≈ z – закон Мозли (6)
3. Рентгеновские спектры возникают вследствие вырывания из атома одного из внутренних электронов атома . Вследствие чего , если вырывается один из электронов первой внутренней оболочки (К-слой ), на освободившееся место помещаются электроны из оставшихся внешних оболочек. Возникает К-серия , поэтому возникшая К-серия всегда сопровождается возникновением остальных серий.
Частоты , появляющиеся в К-серии можно описать системой уравнений , аналогичной формуле Байера , т.е.
 ωα=R(z-1)2 (1/12-1/22) (7)
ωα=R(z-1)2 (1/12-1/22) (7)
К-серия ωβ=R(z-1)2(1/12-1/32)
………………………
 ωα=R(z-7,5) (1/22-1/32) (8)
ωα=R(z-7,5) (1/22-1/32) (8)
L-серия ωβ=R(z-7,5)(1/22-1/42)
Соотношения (7)и(8) можно объединить универсальной формулой , описывающей весь рентгеновский спектр,
ω=R(z−σ)2(1/n21-1/n22) (9)
причем постоянная σ называется константой экранирования .Следовательно закон Мозели с учетом формулы (9) запишется в виде
 √ω = с(z−σ) (10)
√ω = с(z−σ) (10)

Т.е. корень квадратный из частоты в характеристических спектрах является линейной функцией атомного номера элементов анода и позволяет определить заряд ядра .
СТРОЕНИЕ СЛОЖНЫХ АТОМОВ.
Чтобы описать сложный атом , необходимо описать состояние ядра , состояние электронных оболочек , взаимодействие между ядром и электронными оболочками , а так же электронных оболочек между собой.
1. Состояние электрона в сложном атоме описывается четверкой квантовых чисел.
а) Появление орбитального (азимутального) квантового числа еприводит к тому , что для значений энергии квантовых орбит получается более сложное выражение – энергия становится функцией двух переменных квадрат чисел , т.е. Еn= f(n,e)
Еn= − Rhc/(n-∆)2 (11)
где n-главное квантовое число , ∆- квантовый дефект : ∆=f(e) , (n-∆)=n*-эффективное главное квантовое число, тогда
Еn= − Rhc/ n*2 ; Еn= − Rhc(1/ n*2) (12)
Формула позволила удовлетворительно описать спектры щелочных элементов и изоэлектронных с ними ионов , т.е. таких , у которых благодаря ионизации удалены с наружной электронной оболочки все электроны , кроме одного .
Электроны с одним главным квантовым числом образуют электронную оболочку.
б) Для электрона ,находящегося на данной электронной оболочке , т.е. с разным главным квантовым числом , орбитальное квантовое число еможет принимать различные значения : (всего n-значений)
| е | … | |||||||
| главная | резкая | диффузная | фундаментальная | |||||
| Обозначение в спектроскопии | s | p | d | f | g | h | (n-1) | |
| Первые буквы анг. слова | sharp | principal | diffus | fundamental | ||||
В состоянии с данным значением квантового числа еэлектрон имеет моментколичества движения:
 М = ћ√ е (е+1) (13)
М = ћ√ е (е+1) (13)
Электроны с одним и тем же значением еобразуют подоболочку . С механическим моментом количества движения электрона связан орбитальный магнитный момент μe
 μе= (е / 2 m0с)М , μе= μ0√е(е+1) , (14)
μе= (е / 2 m0с)М , μе= μ0√е(е+1) , (14)
где μ0=(е/2 m0с)ћ .
в) Магнитное орбитальное квантовое число m – определяет проекцию орбитальных ,механического М и магнитного μ, моментов электрона на некоторое произвольное направление z , обычно на направление магнитного поля.
При данном значении ечислоmможет иметь (2e+1) значений , и принимать значения :
m= е, е-1 ,…,+1, 0 , -1, …, -(е-1), …, -е.
При данном n всего различных состояний будет :
n-1
∑ (2е+1)=n2 (15)
e=0
 г) Спиновое квантовое число s определяет собственным механическим моментом электрона , величина которого:
г) Спиновое квантовое число s определяет собственным механическим моментом электрона , величина которого:
 S= √s(s+1) ћ (16)
S= √s(s+1) ћ (16)
 Спиновое квантовое число имеет одно единственное значение S=1/2, так что S= (√3 /2) ћ
Спиновое квантовое число имеет одно единственное значение S=1/2, так что S= (√3 /2) ћ
 Проекция спина имеет два значения Sz=+1/2 ћ .
Проекция спина имеет два значения Sz=+1/2 ћ .
Состояние электрона описывается набором четырех динамических величин , т.е. ψn= ψn(n,e,m,s)
СПИН-ОРБИТАЛЬНОЕ ВЗАИМОДЕЙСТВИЕ В АТОМЕ.


 Орбитальное движение электрона создает магнитное поле Н, с которым взаимодействует собственный магнитный момент электрона . Это взаимодействие называется спин-орбитальным. Спин-орбитальное взаимодействие вызывает проекцию векторов l и s.
Орбитальное движение электрона создает магнитное поле Н, с которым взаимодействует собственный магнитный момент электрона . Это взаимодействие называется спин-орбитальным. Спин-орбитальное взаимодействие вызывает проекцию векторов l и s.
 Если принять векторную модель атома , то j=l+s, где векторы подчиняются правилам квантования моментов :
Если принять векторную модель атома , то j=l+s, где векторы подчиняются правилам квантования моментов :

 |j|=ћ√j(j+1)
|j|=ћ√j(j+1)

 |e|=ћ√e(e+1) (17)
|e|=ћ√e(e+1) (17)
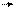
 |s|=ћ√s(s+1)
|s|=ћ√s(s+1)
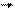 j-квантовое число полного момента атома.
j-квантовое число полного момента атома.
Орбитальный момент атома равен векторной сумме орбитальных моментов всех электронов ,

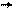 n
n
т.е. J=∑ ji . (18)
i=0
 Одно и то же количество электронов может дать различные значения J , а следовательно , различные состояния атома.
Одно и то же количество электронов может дать различные значения J , а следовательно , различные состояния атома.
Полный спиновой момент может иметь лишь (2s+1) значения.
ПРИНЦИП ПАУЛИ.
Частицы с целым или нулевым спином могут находиться в пределах данной системы в одинаковом состоянии в неограниченном количестве . Такие частицы подчиняются статистике , разработанной Бозе и Эйнштейном, и поэтому называют бозонами. Можно сказать , что бозоны являются «коллективистами», они «любят» накапливаться в одном и том же состоянии .
Частицы в квантовом состоянии могут находиться только поодиночке . Такие частицы подчиняются статистике , разработанной Ферми и Дираком , и называют фермионами. Фермионы являются «индивидуалистами».
В 1925г. Паули сформулировал носящий его имя принцип , согласно которому в одном и том же атоме (или в какой-либо другой квантовой системе) не может быть двух электронов(либо других частиц с полуцелым спином) , обладающих одинаковой совокупностью квантовых чисел. Иными словами , в одном и том же состоянии не могут одновременно находиться два электрона.
Совокупность электронов , имеющих одинаковые значения квантового числа n , образ0уют оболочку . Оболочки подразделяются на подоболочки, отличающиеся значением квантового числа l .В соответствии с значением n оболочкам дают обозначения, заимствованные из спектроскопии рентгеновских лучей
| Значение n | … | |||||||
| Обозначение оболочки | K | L | M | N | O | P | Q | ... |
Подразделении возможных состояний электрона в атоме на оболочки и подоболочки показано в таблице , где вместо ms=1/2 применены для наглядности символы ↑↓.
| оболочка | n | l | ml | ms | подоболочка | оболочка | n | l | ml | ms | подоболочка |
| K | ↑↓ | K(1s) | N | ↑↓ | N1(4s) | ||||||
| L | ↑↓ | L1(2s) | |||||||||
| -1 +1 | ↑↓ ↑↑ ↑↓ | L2(2p) | -1 +1 | ↑↓ ↑↓ ↑↓ | N2(4p) | ||||||
| M | ↑↓ | M1(3s) | |||||||||
| -1 +1 | ↑↓ ↑↓ ↑↓ | M3(3p) | -2 -1 +1 +2 | ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ | N3(4d) | ||||||
| -2 -1 +1 +2 | ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ | M3(3d) | -3 -2 -1 +1 +2 +3 | ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ | N4(4f) | ||||||
Для полностью заполненной подоболочки характерно равенство нулю суммарного орбитального и суммарного спинового моментов (L=0, S=0 ). Следовательно момент импульса такой подоболочки равен нулю (J=0).
Принцип Паули дает объяснения периодической повторяемости свойств атомов. Проследим построение периодической системы элементов Д.И.Менделеева . Начнем с атома водорода имеющего один электрон . Каждый следующий атом будем получать , увеличивая заряд ядра предыдущего атома на единицу и добавляя один электрон, который мы будем помещать в доступное ему согласно принципу Паули состояние с наименьшей энергией.
В атоме водорода имеется в основном состоянии один 1s-электрон с произвольной ориентацией спина. Квантовые числа атома имеют значения : L=0, S=1/2, J=1/2. Соответственно символ основного состояния водородного атома имеет вид 2S1/2.
Если заряд ядра атома водорода увеличить на единицу и добавить еще один электрон , получится атом гелия . Оба электрона в этом атоме могут находиться в К-оболочке , но с антипараллельной ориентацией спинов. Так называемая электронная конфигурация атома может быть записана как 1s2 (два 1s-электрона). Основным состоянием будет 1S0 (L=0, S=0, J=0).
На атоме гелия заканчивается заполнение К-оболочки. Третий электрон атома лития может занять лишь уровень 2s .
|

| ||||||
| 
|  
|  
| |||
|  
|  
|  
|  
| ||
| H 2S1/2 | He 1S0 | Li 2S1/2 | Be 1S0 | B 2S1/2 |
Получается электронная конфигурация 1s22s.Основное состояние характеризуется квантовыми числами L=0, S=1/2, J=1/2 . Поэтому основным состоянием , как и у водорода, будет 2S1/2. Третий электрон атома лития , занимая более высокий энергетический уровень , чем остальные два электрона , оказывается слабее , чем они , связанным с ядром атома. В результате он определяет оптические и химические свойства атома . И т.д.
Процесс застройки электронных оболочек первых 36 элементов периодической системы представлен в таблице.
| элемент | K | L | M | N |
| 1s |  2s 2р 2s 2р
|   3s 3p 3d 3s 3p 3d
|  4s 4p 4s 4p
| |
| 1 He 2 He |   — — — —
|      — — — — — —
| — —
  
| |
| 3 Li 4 Be 5 B 6 C 7 N 8 O 9 F 10 Ne | 1  —
2 —
2 1
2 2
2 3
2 4
2 5
2 6 —
2 —
2 1
2 2
2 3
2 4
2 5
2 6
| — — — — — — — — — — — — — — — — — — — — — — — — | — — — — — — — — — — — — — — — — |
| 11 Na 12 Mg 13 Al 14 Si 15 P 16 S 17 Cl 18 Ar | — — | — — — — — — — — | — — — — — — — — | — — — — — — — — | ||||
| 19 K 20 Ca 21 Sc 22 Ti 23 V 24 Cr 25 Mn 26 Fe 27 Co 28 Ni | — — | — — — — — — — — — — | ||||||
| 29 Cu 30 Zu 31 Ga 32 Ge 33 As 34 Se 35 Br 36 Kr | — — | |||||||
| элемент | 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p |
| K | L | M | N | |||||
| <== предыдущая лекция | | | следующая лекция ==> |
| Компьютерные программы MeChem и ChemNet | | | Физика явления. Рентгеновские лучи |
Дата добавления: 2020-07-18; просмотров: 159;










