Электрокинетические явления
Электрокинетическими явлениями назвали процессы, происходящие в дисперсных системах и связанные с перемещением фаз относительно друг друга под действием внешнего электрического поля. Эти явления впервые были обнаружены Ф.Ф. Рейсом в 1807 г. Причиной их является существование двойного электрического слоя на границе гранула – диффузный слой и легкость смещения гранулы относительно диффузного слоя. В электрическом поле при наложении внешней разности потенциалов двойной электрический слой разрывается по границе (поверхности) скольжения и частица получает заряд, соответствующий x-потенциалу. При этом гранула движется к одному полюсу, а противоионы диффузного слоя, увлекая за собой гидратные оболочки, – к другому.
Движение частиц дисперсной фазы относительно дисперсионной среды под действием внешнего электрического поля называется электрофорезом.
Движение дисперсионной среды относительно дисперсной фазы под действием внешнего электрического поля называется электроосмосом.
Позже, в 1859 г, Квинке обнаружил, что при проталкивании под давлением коллоидного раствора через капилляр на его концах возникает разность потенциалов, названная потенциалом протекания. Это явление можно рассматривать как обратное электроосмосу.
Явление, обратное электрофорезу открыл в 1878 г. Дорн. Он установил, что при оседании частиц дисперсной фазы в жидкой среде по высоте сосуда возникает разность потенциалов между верхним и нижним слоями. Ее назвали потенциалом седиментации. Причина этого явления – деформация ДЭС оседающих частиц при трении о дисперсионную среду.
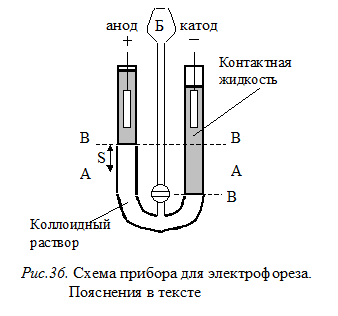 Электрофорез коллоидных растворов.Метод электрофореза позволяет определить знак заряда частиц золя, а также величину x-потенциала. Наблюдать электрофорез коллоидных растворов можно с помощью прибора, изображенного на рис.36. Прибор представляет собой U–образную трубку, в колена которой вставлены электроды. Коллоидный раствор вводят через трубочку Б до уровня А – А. На поверхность раствора налита контактная жидкость, которая является дисперсионной средой золя или имеет одинаковую с ней электропроводность. На электроды подают напряжение. Через некоторое время уровень золя изменится в обоих коленах (В – В).
Электрофорез коллоидных растворов.Метод электрофореза позволяет определить знак заряда частиц золя, а также величину x-потенциала. Наблюдать электрофорез коллоидных растворов можно с помощью прибора, изображенного на рис.36. Прибор представляет собой U–образную трубку, в колена которой вставлены электроды. Коллоидный раствор вводят через трубочку Б до уровня А – А. На поверхность раствора налита контактная жидкость, которая является дисперсионной средой золя или имеет одинаковую с ней электропроводность. На электроды подают напряжение. Через некоторое время уровень золя изменится в обоих коленах (В – В).
В электрическом поле противоионы диффузного слоя обычно двигаются в направлении, противоположном движению гранул. При этом в соответствующем колене прибора повышается уровень жидкости, так как ионы диффузного слоя увлекают за собой дисперсионную среду за счет сил межмолекулярного трения (вязкости) между гидратной оболочкой ионов и окружающей жидкостью. То есть в данном колене наблюдается электроосмос.
Но это только в том случае, если на пути передвижения стоит мембрана, препятствующая движению гранул (т.е. фаза закреплена).
При свободном передвижении диффузный слой удерживается гранулой и в виде отстающего «хвоста» следует вместе с ней. Поэтому уровень золя будет повышается в электродном пространстве, имеющим знак заряда, противоположный заряду частиц. Следовательно, в нашем случае частицы золя заряжены отрицательно, так как уровень жидкости повысился в анодном пространстве.
Зная величину смещения уровня (S) за определенный промежуток времени (t), можно экспериментально рассчитать скорость электроосмоса (электрофореза): V = S/t, м/с. С другой стороны, скорость движения частиц дисперсной фазы в электрическом поле по уравнению Гельмгольца – Смолуховского равна:
V = 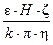 ,
,
где V – линейная скорость перемещения частиц (или границы золя), м/с; ε – относительная диэлектрическая проницаемость среды; Н – напряженность электрического поля (градиент потенциала), В/м; k – коэффициент, зависящий от формы частиц (k = 4 – для сферических частиц, k = 6 – для цилиндрических);
η – вязкость среды, Н×с/м2; x – электрокинетический потенциал, В.
Как видно из уравнения, скорость электрофореза тем больше, чем выше диэлектрическая проницаемость среды, напряженность электрического поля, величина ξ -потенциала (т.е. заряд частиц) и чем меньше вязкость среды, а также зависит от формы частиц.
Последнее уравнение позволяет рассчитать величину x-потенциала:
x = 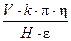 .
.
Линейная скорость электрофореза (V) изменяется пропорционально напряженности электрического поля и не может служить характеристикой частиц. Поэтому было введено понятие электрофоретическая подвижность (u):
u = V/Н, м2/с×В.
Следовательно: x = 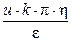 .
.
Величина x-потенциала позволяет судить об устойчивости коллоидного раствора, поскольку последняя зависит от этой величины.
Уравнение Гельмгольца – Смолуховского также применимо для электрофореза аминокислот и белков, где x-потенциал определяется суммарным зарядом иона.
Электрофорез аминокислот и белков. Разделение белков, аминокислот методом электрофореза основано на способности их молекул принимать определенный знак заряда в зависимости от рН среды.
Аминокислоты, являясь структурной единицей белков, своим строением и последовательностью соединения молекул определяют специфичность и свойства белков. Так как их молекулы содержат и основную (–NH2), и кислотную (–СООН) группы, то они являются амфотерными соединениями и в водных растворах находятся в виде биполярных ионов:
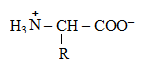
В нейтральной среде заряд иона аминокислоты (или белка) определяется соотношением числа –NH2 и –СООН групп и степенью их диссоциации. Если число карбоксильных групп больше числа аминогрупп, суммарный заряд иона будет отрицательный, если больше аминогрупп – положительный. Если же количество этих групп в ионе одинаково, то суммарный заряд равен нулю.
Ионизация амино- и карбоксильных групп зависит также от рН среды. В кислой среде диссоциация карбоксильной группы подавляется и протонируется аминогруппа. В результате аминокислота (белок) приобретает положительный заряд:
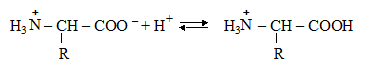
В щелочной среде аминокислота приобретает отрицательный заряд:
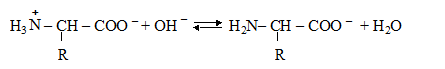
При некотором значении рН среды, характерном для данной аминокислоты (белка), суммарный заряд иона равен нулю. Состояние, в котором молекула аминокислоты или белка обладает равенством положительных и отрицательных зарядов, то есть электронейтральна, называется изоэлектрическим состоянием. А значение рН среды, при котором молекула электронейтральна, называется изоэлектрической точкой (ИЭТ или рJ).
В средах, где рН<pJ, молекула белка (аминокислоты) заряжается положительно в электрическом поле двигается к катоду. Если рН>pJ, то молекула заряжается отрицательно и в электрическом поле перемещается к аноду.
ИЭТ белков с преобладанием –СООН групп (кислых белков) находиться в кислой среде, а с преобладанием – NH2 групп (основных белков) – в щелочной. Если число амино- и карбоксильных групп равно, то ИЭТ будет находится приблизительно в нейтральной среде, что зависит от степени диссоциации этих групп. Следовательно, суммарный заряд иона белка (аминокислоты) зависит также от рН среды и ИЭТ белка (аминокислоты).
Любой раствор рН которого меньше, чем ИЭТ, является кислым для молекулы данного белка (аминокислоты), и она, приобретая положительный заряд, в электрическом поле двигается к катоду. Если рН раствора больше чем ИЭТ, то данная среда является щелочной для молекулы, и она, приобретая отрицательный заряд, в электрическом поле двигается к аноду.
Наблюдать электрофорез аминокислот и белков можно с помощью прибора, схема которого изображена на рис.37а. Он представляет собой ванну, состоящую из катодного и анодного отделений, в которые заливается буферный раствор с определенным значением рН. Берется полоска плотной фильтровальной бумаги, пропитанной тем же буферным раствором. На её середину полоски (линия старта) наносят небольшое количество смеси белков, которые необходимо разделить, а на концах ее ставят знаки «+» и «–». Затем полоску помещают на подставке в прибор так, что бы один конец (–) погрузился в раствор катодного отделения, а второй (+) – анодного, и подают внешнее напряжение. Через некоторое время прибор отключают, бумагу вынимают, высушивают и окрашивают красителем, проявляющим белки. На полученной электрофореграмме (рис.37б) будет наблюдаться несколько окрашенных зон. Их число соответствует числу компонентов в смеси. Характер расположения и интенсивность полос на ней определяются качественным и количественным составом белков в смеси.
 Так как все компоненты имеют различную электрофоретическую подвижность, то они окажутся на различном расстоянии от линии старта. Причем чем дальше от линии старта оказалась зона, тем выше скорость электрофореза вследствие большей величины ξ-потенциала (заряда) молекулы данного белка (аминокислоты). По направлению движения зон можно судить о заряде молекулы в данной среде. Если зона двигалась к катоду (–), то знак заряда положительный, если к аноду (+) – отрицательный.
Так как все компоненты имеют различную электрофоретическую подвижность, то они окажутся на различном расстоянии от линии старта. Причем чем дальше от линии старта оказалась зона, тем выше скорость электрофореза вследствие большей величины ξ-потенциала (заряда) молекулы данного белка (аминокислоты). По направлению движения зон можно судить о заряде молекулы в данной среде. Если зона двигалась к катоду (–), то знак заряда положительный, если к аноду (+) – отрицательный.
Электрофорез и электроосмос широко применяются в медико-биологических исследованиях. Например, методом электрофореза разделяют белки, нуклеиновые кислоты, антибиотики, смеси лекарственных веществ в лекарственных препаратах, очищают от примесей лекарственные сыворотки, определяют белковые фракции в сыворотке крови. Этим методом можно не только разделять аминокислоты и белки, но и определять их ИЭТ. Если проводить электрофорез данного белка (аминокислоты) при разных значениях рН среды, то при рН равном ИЭТ это вещество не будет двигаться ни к катоду, ни к аноду.
Методы электрофореза применяются при диагностике ряда заболеваний и для контроля лечения путем сравнивания фракционного состава (по числу и интенсивности зон на электрофореграмме) нормальных и патологических жидкостей.
Электрофорез и электроосмос происходят при прохождении тока через ткани живых организмов. На поверхности биологических мембран находятся заряженные группы, что обуславливает образование двойного электрического слоя, в котором фиксированный отрицательный заряд клеточной поверхности уравновешивается положительным зарядом, создаваемым ионами межклеточной среды. Поэтому метод электрофореза позволяет определить величину x-потенциала, а следовательно, и заряд эритроцитов, тромбоцитов, лейкоцитов и других элементов крови. Достаточно хорошо изучен электрокинетический потенциал эритроцитов. Было установлено, что величина x-потенциала является характерной для данного вида животных, а также для человека.
Электрофорез (ионофорез) является одним из методов введения лекарственных препаратов в организм человека. Он широко применяется в физиотерапии, поскольку имеет ряд преимуществ по сравнению с другими способами введения лекарств. При электрофорезе оно поступает непосредственно в ткани зоны воздействия (следовательно, требуются меньшие дозы) и действует медленнее, но продолжительнее.
Устойчивость и коагуляция коллоидных растворов
Коллоидные растворы из-за большой удельной поверхности на границе раздела фаз имеют избыток поверхностной энергии и поэтому термодинамически неустойчивы. И только присутствие стабилизатора придает им устойчивость.
Под устойчивостью дисперсных систем понимают постоянство во времени их свойств, в первую очередь постоянство дисперсности и постоянство равновесного распределения частиц дисперсной фазы в среде. В данном определении имеется в виду способность системы противостоять агрегации (укрупнению) частиц дисперсной фазы – агрегативная устойчивость, и способность системы противостоять седиментации частиц (т.е. их осаждению под действием силы тяжести) – седиментационная (кинетическая) устойчивость.
Способность частиц дисперсной фазы удерживаться во взвешенном состоянии зависит от их дисперсности, вязкости дисперсионной среды, разности плотностей дисперсной фазы и дисперсионной среды. Кинетическая (седиментационная) устойчивость золя тем выше, чем меньше размер частиц, чем ближе значения плотностей фазы и среды, чем выше вязкость дисперсионной среды. Причем степень дисперсности частиц оказывает наибольшее влияние. Поэтому высокодисперсные системы, в которых скорость осаждения взвешенных частиц под влиянием силы тяжести настолько мала, что ею можно пренебречь, принято называть седиментационно (кинетически) устойчивыми.
Агрегативная устойчивость характеризует способность частиц дисперсной фазы оказывать сопротивление их слипанию и тем удерживать определенную степень дисперсности. Основными факторами агрегативной устойчивости дисперсных систем являются наличие у частиц ионной оболочки, т.е. ДЭС, диффузного слоя противоинов, а так же их сольватной (гидратной) оболочки. Эти факторы оценивают величиной электротермодинамического потенциала j коллоидной частицы, толщиной ее диффузного слоя, величиной заряда частицы и ее x-потенциала. Их значения зависят от условий получения золя, а также от природы противоиона (его заряда, радиуса, гидратирующей способности). В зависимости от этих условий изменяется количество противоионов в диффузном слое. Чем больше противоионов в нем, тем больше его толщина и, соответственно, выше заряд и x-потенциал частицы. Это способствует увеличению агрегативной устойчивости. Утрата агрегативной устойчивости приводит к коагуляции.
Коагуляция – это процесс слипания коллоидных частиц и образования более крупных агрегатов, ведущий к выпадению их в осадок под действием сил тяжести и последующему разделению фаз. Другими словами это потеря в начале агрегативной, а затем седиментационной устойчивости, ведущая к разрушению дисперсной системы. В общем смысле под коагуляцией понимают потерю агрегативной устойчивости дисперсной системы.
Коагуляцию могут вызвать различные факторы: изменение температуры, механическое воздействие, действие света, облучение, увеличение концентрации золя, добавление электролитов.
Изменение температуры по-разному влияет на кинетическую и агрегативную устойчивость, а следовательно, и на коагуляцию. Первая при увеличении температуры возрастает в результате усиления броуновского движения. Вторая при этом снижается вследствие уменьшения толщины диффузного слоя. Причем увеличивается и вероятность столкновения (соответственно – слипания) частиц, что способствует коагуляции.
Наиболее изучена и имеет большое практическое значение коагуляция электролитами. Электролиты, с одной стороны, необходимы для стабилизации золя, но с другой – их избыток в растворе вызывает коагуляцию. Поэтому коллоидные растворы, полученные химическими методами, необходимо очищать от примесей электролитов.
Коагуляция коллоидных растворов электролитами.Количественной характеристикой коагулирующей способности электролита служит порог коагуляции – наименьшее количество электролита, которое вызывает коагуляцию I л золя. Он рассчитывается по формуле:
γ = 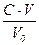 ,
,
где γ – порог коагуляции, моль/л; С – концентрация электролита, моль/л; V – объем раствора электролита, л; V0 – объем золя, л.
Порог коагуляции можно рассчитывать и в ммоль/л.
Величина, обратная порогу коагуляции (1/γ), является мерой коагулирующей способности электролита: чем меньше порог коагуляции, тем выше коагулирующая способность электролита.
Практически все электролиты способны вызвать коагуляцию золя, если концентрацию электролита увеличить до значений, соответствующих его порогу коагуляции для данного золя.
Коагулирующее действие электролитов зависит от знака заряда и величины заряда ионов и определяется правилом Шульце – Гарди.Коагуляцию вызывают в основном ионы, имеющие заряд, противоположный знаку заряда частицы (М. Гарди). То есть для золя с положительно заряженными частицами ионами-коагулянтами являются анионы, а коагуляцию отрицательно заряженного золя вызывают катионы добавляемого электролита. Ичем выше заряд иона коагулянта, тем выше его коагулирующая способность(Г. Шульце),т.е. требуется меньшее количество электролита для коагуляции (порог коагуляции меньше). Позже Б.В.Дерягиным было установлено, что если коагуляцию вызываютионы одного знака, но разной величины заряда, то их пороги коагуляции соотносятся как величины, обратные их зарядам в шестой степени:
g+ : g2+ : g3+ = 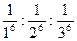 = 730 : 11:1
= 730 : 11:1
Поскольку порог коагуляции зависит не только от природы иона-коагулянта, но и от природы иона, сопутствующего ему, а также условий проведения опыта, на практике наблюдаются отклонения от указанного соотношения. В настоящее время установлено, что порог коагуляции пропорционален величине заряда иона-коагулянта в степени от 2 до 9, часто в степени 6.
У ионов одного знака и одинаковой величины заряда пороги коагуляции также отличаются друг от друга, но незначительно.
Коагуляция в ряде случаев зависит от способа прибавления электролита-коагулятора. Экспериментальные данные свидетельствуют о том, что если электролит добавлять к золю небольшими порциями, то в итоге коагуляция наступает при более высокой концентрации электролита, чем при внесении сразу большого его количества. Такое явление называют привыканием золя.
Явление коагуляции электролитами играет существенную роль в живом организме, так как коллоидные растворы клеток и биологических жидкостей соприкасаются с электролитами. Поэтому при введении в организм какого-либо электролита надо учитывать не только его концентрацию, но и заряд ионов. К примеру, физиологический раствор хлорида натрия нельзя заменить изотоничным раствором хлорида магния, поскольку данная соль содержит двухзарядный ион магния, оказывающий более высокое коагулирующие действие.
 Кинетика и механизм коагуляции электролитами. Коагуляция любого коллоидного раствора не происходит мгновенно – она протекает во времени. Процесс коагуляции можно наблюдать по изменению оптических свойств раствора. Различают две стадии коагуляции: скрытую и явную. На первой стадии происходит укрупнение частиц без видимых изменений оптических свойств раствора (скрытая коагуляция). На второй стадии идет дальнейшее укрупнение частиц, сопровождающееся видимым изменением золя (явная коагуляция).
Кинетика и механизм коагуляции электролитами. Коагуляция любого коллоидного раствора не происходит мгновенно – она протекает во времени. Процесс коагуляции можно наблюдать по изменению оптических свойств раствора. Различают две стадии коагуляции: скрытую и явную. На первой стадии происходит укрупнение частиц без видимых изменений оптических свойств раствора (скрытая коагуляция). На второй стадии идет дальнейшее укрупнение частиц, сопровождающееся видимым изменением золя (явная коагуляция).
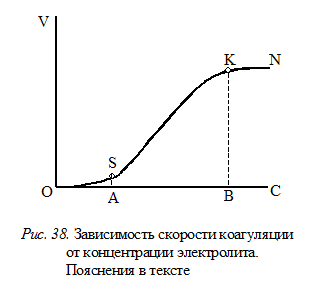
На рис.38 показана кривая (OSKN) зависимости скорости коагуляции золя от концентрации добавляемого электролита. Отрезок ОS соответствует скрытой коагуляции,а точка А – концентрации электролита при пороге коагуляции, который можно зафиксировать. Признаками явной коагуляции являются помутнение золя или изменение его окраски.
В начале явной коагуляции (отрезок SКN) скорость ее невелика. Но по мере нарастания концентрации электролита она значительно увеличивается. Поэтому различают медленную (SК) и быструю (КN) коагуляцию. Точка В соответствует концентрации электролита при некотором остаточном значении x-потенциала (в литературе его называют критическим x-потенциалом).
Существуют различные теории, описывающие механизм коагуляции. Из них наиболее удовлетворительной считается теория Дерягина – Ландау, доработанная Э.Фербеем и Дж.Обербеком (теория коагуляции ДЛФО). Согласно этой теории, две коллоидные частицы в процессе броуновского движения могут сблизиться на расстояние, при котором перекрываются их диффузные оболочки. Только в этом случае они начинают испытывать силы межмолекулярного притяжения и силы электростатического отталкивания их диффузных слоев.
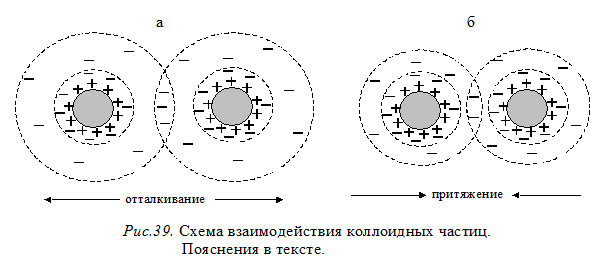 В первом приближении механизм ионной стабилизации сводится к электростатическому отталкиванию диффузных слоев, зависящему от их толщины. При большой толщине диффузных слоев (рис.39а) их перекрытие проявляется на расстоянии, когда силы отталкивания одноименно заряженных слоев больше сил межмолекулярного притяжения и коллоидные частицы не слипаются (не агрегируют). При малой толщине диффузных слоев (рис.39б) частицы сближаются до расстояния, на котором межмолекулярное притяжение сильнее отталкивания этих слоев, и тогда происходит их агрегация, т.е. коагуляция.
В первом приближении механизм ионной стабилизации сводится к электростатическому отталкиванию диффузных слоев, зависящему от их толщины. При большой толщине диффузных слоев (рис.39а) их перекрытие проявляется на расстоянии, когда силы отталкивания одноименно заряженных слоев больше сил межмолекулярного притяжения и коллоидные частицы не слипаются (не агрегируют). При малой толщине диффузных слоев (рис.39б) частицы сближаются до расстояния, на котором межмолекулярное притяжение сильнее отталкивания этих слоев, и тогда происходит их агрегация, т.е. коагуляция.
Согласно теории ДЛФО, введение в дисперсную систему электролита вызывает сжатие ионной оболочки частиц за счет избирательной или ионнообменной адсорбции на их поверхности ионов данного электролита. При этом понижается заряд частицы, ее x-потенциал и, следовательно, толщина диффузного слоя. Уменьшение толщины диффузного слоя приводит к преобладанию сил межмолекулярного притяжения над силами электростатического отталкивания, вследствие чего скорость коагуляции возрастает.
В этом механизме коагуляции золей электролитами учтено взаимодействие сил молекулярного притяжения и электростатического отталкивания, но не учтены силы взаимодействия адсорбционно-сольватных оболочек частиц и другие факторы, что является недостатком теории ДЛФО.
Коагуляция золя смесями электролитов.Коагуляцию золей можно вызвать и смесями электролитов, которые способны оказывать на них различные действия (рис. 40).
1. Коагулирующее действие смеси электролитов суммируется, т.е. смесь электролитов оказывает тоже действие, как один из них, взятый тем же количеством – аддитивное действие.
2. Коагулирующее действие смеси электролитов меньше, чем каждого из них в отдельности, т.е. для коагуляции золя количества смеси потребуется больше чем количества каждого из них в отдельности – антагонизм. Это характерно для смесей ионов, имеющих различную валентность.
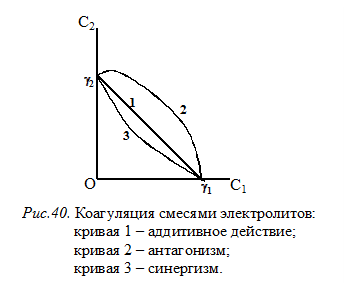 3. Коагулирующее действие смеси электролитов большее, чем каждого из них в отдельности, т.е. количества смеси потребуется меньше чем количества одного из электролитов в отдельности – синергизм.
3. Коагулирующее действие смеси электролитов большее, чем каждого из них в отдельности, т.е. количества смеси потребуется меньше чем количества одного из электролитов в отдельности – синергизм.
Выше описанные явления очень важны для понимания закономерностей воздействия ионов на органы и ткани живого организма, поскольку биологически активные ионы часто выступают в роли «антагонистов» или «синергистов». Это обстоятельство должно учитываться при составлении кровезамещающих растворов: они должны быть не только изотоническими плазме крови и иметь одинаковую с ней ионную силу, но и быть максимально близкими по ионному составу. Однако описанные явления ни в коем случае нельзя смешивать с явлениями физиологического антагонизма ионов, под которым обычно понимают ослабление одним катионом токсического или иного физиологического действия, вызываемого другим катионом.
Взаимная коагуляция золей. Помимо электролитов, коагуляцию золей можно вызвать путем смешивания одного их них в определенных количественных соотношениях с другим золем, гранулы которого имеют противоположный знак заряда. Это явление носит название взаимной коагуляции. Причем даже при незначительной концентрации противоположно заряженных частиц скорость коагуляции существенно возрастает.
Механизм взаимной коагуляции заключается в следующем. При перекрывании диффузных слоев коллоидных частиц, имеющих заряды разных знаков, эти частицы не отталкиваются, а электростатически притягиваются, и как следствие этого идет быстрая агрегация частиц. Наиболее полно взаимная коагуляция происходит тогда, когда заряды частиц, противоположные по знаку, равны между собой по величине.
Данный процесс широко применяется при очистке природных и промышленных вод. Так, перед поступлением воды на песчаные фильтры к ней добавляют соли алюминия или железа. Образующиеся в результате гидролиза этих солей положительно заряженные золи гидроксида алюминия или железа вызывают быструю коагуляцию взвешенных отрицательно заряженных частиц почвы, микрофлоры и т.д.
Коллоидная защита
Устойчивость коллоидных растворов можно повысить, используя не только малые количества электролита, но и добавляя к нему высокомолекулярные соединения (ВМС). Повышение устойчивости коллоидного раствора при добавлении к нему ВМС назвали коллоидной защитой. Это явление выражается в повышении порога коагуляции. Если, например, к золю гидроксида железа (III) добавить небольшое количество раствора желатина, то для коагуляции такого золя требуется значительно больше электролита, чем для коагуляции незащищенного золя. При выпаривании защищенных коллоидных растворов досуха часто получают осадки, способные снова переходить в золи при простом соприкосновении с дисперсионной средой.
Механизм защитного действия сводится к образованию вокруг коллоидной частицы адсорбционной оболочки из молекул ВМС, которые создают структурно-механический барьер, препятствующий слипанию частиц. При этом повышается не только агрегативная, но и седиментационная устойчивость золя вследствие повышения вязкости дисперсионной среды.
Устойчивость гидрозолей повышают, вводя в них некоторое количество полярных ВМС (белки, полисахариды, пектины), обладающих большой устойчивостью к коагулирующему действию электролитов. Устойчивость лиозолей с неполярной дисперсионной средой можно повысить добавлением к ним неполярного ВМС, например, каучука.
Коллоидные частицы, защищенные слоем белка, устойчивы и по своим свойствам не отличаются от макромолекул белка. Примером таких дисперсных систем могут служить медицинские бактерицидные препараты протаргол и колларгол, представляющие собой золи металлического серебра, защищенные белками. Эти препараты приобретают устойчивость, сохраняющуюся даже при полном удалении дисперсионной среды. Следует отметить, что бактерицидное действие, свойственное тяжелым металлам, не экранизируется белковой оболочкой.
Такие биологические жидкости, как кровь, плазма, лимфа, спинномозговая жидкость представляют собой системы, в которых некоторые входящие в них вещества, находятся в коллоидном состоянии, например, фосфаты, ураты, оксалаты, карбонаты, холестерин, липиды. В крови кристаллы малорастворимых соединений не выпадают в осадок потому, что защищены от коагуляции белками. Согласно одной из теорий, с возрастом защитная функция белков снижается, и возникают различные заболевания, например атеросклероз, кальциноз, подагра, образование камней в почках, печени и т.д.
Основные вопросы темы
1. Дисперсные системы, их особенности и классификация.
2. Молекулярно-кинетические свойства коллоидных систем. Седиментация.
3.Оптические свойства коллоидных систем. Опалесценция.
4.Строение коллоидных частиц.
5. Методы получения и очистки коллоидных растворов. Пептизация.
6. Строение и механизм двойного электрического слоя частиц золя.
7. Электрокинетический и электротермодинамический потенциалы, возникновение, механизм и факторы, определяющие их.
8. Электрокинетические явления в коллоидных растворах.
9. Электрофорез коллоидных растворов. Факторы, определяющие скорость электрофореза.
10.Белки как полиэлектролиты. Изоэлектрическое состояние и изоэлектрическая точка белков. Влияние рН раствора на характер ионизации белков.
11. Электрофорез в растворах белков.
12. Значение электрофореза и электроосмоса в медико-биологических исследованиях и физиотерапевтической практике.
13. Виды и факторы устойчивости коллоидных систем.
14. Коагуляция коллоидных растворов и вызывающие ее факторы.
15. Коагуляция коллоидных растворов электролитами. Порог коагуляции.
16. Кинетика и механизм коагуляции коллоидных растворов.
17. Процессы коагуляции при очистке питьевой и сточных вод.
18. Коллоидная защита и ее значение.
Дата добавления: 2020-07-18; просмотров: 481;










