Закон Гесса и его следствия
В основе термохимических расчетов лежит закон открытый российским ученым Гессом Г. И. (1841 г.). Суть его в следующем: тепловой эффект химической реакции зависит только от начального и конечного состояния системы, но не зависит от скорости и пути процесса, то есть от числа промежуточных стадий.Это, в частности, значит, что термохимические реакции можно складывать вместе с их тепловыми эффектами. Например, образование CO2 из углерода и кислорода можно представить следующей схемой:
С+О2 DН1 СО21. C(граф.) +O2 (г) = CO2 (г) , DН01 = -396 кДж.
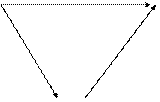 |
2. C(граф.) + 1/2O2 (г) = CO (г) , DН02 = Х кДж.
DН2 DН3
3. CO (г) + 1/2O2 (г) = CO2 (г) , DН03 = -285,5кДж. 
СО + ½О2
Все эти три процесса находят широкое применение в практике. Как известно, тепловые эффекты образования СО2 (DН1) и горения СО (DН3) определяются экспериментально. Тепловой же эффект образования СО (DН2) экспериментально измерить невозможно, так как при горении углерода в условиях недостатка кислорода образуется смесь СО и СО2. Но энтальпию реакции образования СО из простых веществ можно рассчитать.
Из закона Гесса следует, что DH01 = DH02 + DH03. Следовательно,
DH02 = DH01 - DH0 3 = -396 - (-285,5) = -110,5 (кДж) – это и есть истенная величина
Таким образом, пользуясь законом Гесса, можно находить теплоту реакций, которые невозможно определить экспериментально.
В термохимических расчетах широко используют два следствия закона Гесса. По первому, тепловой эффект реакции равен сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ (реагентов).
DН0х.р. = å nпрод·DH0ƒ прод - å nисх ·DН0ƒ реагентов ,
где n - количество вещества; DН0ƒ - стандартная энтальпия (теплота) образования вещества.
Тепловой эффект реакции образования 1 моль сложного вещества из простых веществ, определенный при стандартных условиях, называется стандартной энтальпией образованияэтого вещества (DН0образ или DН0ƒ кДж/моль).
Так как абсолютную энтальпию вещества определить невозможно, то для измерений и расчетов необходимо определить начало отсчета, то есть систему и условия, для которых принимается значение : DН = 0. В термодинамике в качестве начала отсчета принимают состояния простых веществ в их наиболее устойчивых формах при обычных условиях – в стандартном состоянии.
Например: DН0ƒ (О2) = 0, но DН0ƒ (О3) = 142,3 кДж/моль. Стандартные энтальпии образования определены для многих веществ и проведены в справочниках (табл. 5.1).
В общем виде для реакции аА+ вВ = сС + dD энтальпия , согласно первому следствию определяется по уравнению:
DH0298 х.р.= (cDН0ƒ,C + dDН0ƒ,Е) - (аDH0ƒ,A + вDH0ƒ,B).
Второе следствие закона Гесса относится к органическим веществам. Тепловой эффект реакции с участием органических веществ равен сумме теплот сгорания реагентов за вычетом теплот сгорания продуктов.
При этом теплота сгорания определяется в предположении полного
сгорания: углерод окисляется до CO2, водород - до H2O, азот - до N2 .
Тепловой эффект реакции окисления кислородом элементов, входящих в состав вещества, до образования высших оксидов называется теплотой сгорания этого вещества(DН0сг.). При этом очевидно, что теплоты сгорания O2, CO2, H2O, N2 принимаются равными нулю.
Таблица 5.1
Термодинамические константы некоторых веществ
| Вещество | DН0f,298, кДж/ моль | S0298, Дж/ моль×K | DG0f,298, кДж/ моль | Вещество | DН0f,298, кДж/ моль | S0298, Дж/ моль×K | DG0f,298, кДж/моль |
| Al2O3(кр) | -1676,0 | 50,9 | -1582,0 | Cr2O3(кр) | -1140,6 | 281,0 | -1059,0 |
| BaO(кр) | -558,1 | 70,3 | -528,4 | CuO(кр) | -162,0 | 42,6 | -129,4 |
| ВеО(кр) | -598,0 | 14,1 | -581,6 | CuCl2(ж) | -227,6 | 210,9 | -244,6 |
| BeCO3(кр) | -982,0 | 67,3 | -944,8 | H2O(ж) | -285,8 | 70,08 | -237,3 |
| С(графит) | 5,7 | H2O(г) | -241,8 | 188,7 | -228,6 | ||
| Cl2(г) | 222,9 | H2SO4(ж) | -814,2 | 156,9 | -690,3 | ||
| CaO(кр) | -635,5 | 39,7 | -604,2 | HCl(ж) | -166,9 | 56,5 | -131,2 |
| CaH2(кр) | -188,7 | 42,0 | -149,8 | HCl(г) | -91,8 | 186,7 | -94,8 |
| CaCO3(кр) | -1206,9 | 92,9 | -1128,8 | H2S(г) | -21,0 | 205,6 | -33,8 |
| O2(г) | 205,0 | H2 | 130,5 | ||||
| Ca(OH)2 | -986,6 | 76,1 | -896,8 | NH3(г) | -46,2 | 192,5 | -16,7 |
| CH4 | -74,9 | 186,2 | -50,8 | NO | 90,3 | 210,6 | 86,6 |
| C2H4 | 52,3 | 219,4 | 68,1 | NO2 | 33,0 | 240,5 | 51,5 |
| C2H6 | -89,7 | 229,5 | -32,9 | NH4Clкр | -314,2 | 94,5 | -203,2 |
| C6H6(ж) | 82,9 | 269,2 | 129,7 | P2O5(кр) | -1492 | 114,5 | -1348,8 |
| C2H2 | 226,8 | 200,8 | 209,2 | SO3(ж) | -439,0 | 122,1 | -368,1 |
| C3H8(г) | -103,85 | 269,9 | - | Fe | 27,2 | ||
| CH3OH(ж) | - | 126,8 | - | FeO(кр) | -264,8 | 60,7 | -244,3 |
| C2H5OH(г) | -235,3 | - | - | Fe3O4(кр) | -1117,1 | 146,2 | -1014,2 |
| CO | -110,5 | 197,5 | -137,1 | Fe2O3(кр) | -822,2 | 89,9 | -740,3 |
| CO2 | -393,5 | 213,6 | -394,3 | Ti(кр) | 30,6 | ||
| CS2(г) | 115,3 | - | - | TiO2(кр) | -943,9 | 50,3 | -888,6 |
Например, теплоту сгорания этанола
C2H5OH(ж) + 3O2 = 2CO2 + 3H2O(г)
можно рассчитать по уравнению:
DH0х.р. = DН0сг(C2H5OH) = 2DН0ƒ,(CO2) +3DН0ƒ,(H2O) - DН0ƒ,(C2H5OH).
DН0сг (C2H5OH) = 2(-393,5) + 3(241,8) – (-277,7) = -1234,7 кДж/моль.
Значения теплот сгорания также приведены в справочниках.
Пример 1.Определить тепловой эффект реакции дегидратации этанола, если
DH0сг (C2H4) = -1422,8; DH0сг (H2О) = 0; DН0сг (C2H5OH) = - 1234,7 (кДж/моль).
Решение.Запишем реакцию: C2H5OH(ж) = C2H4 + H2O.
Согласно второму следствию определяем тепловой эффект реакции по теплотам сгорания, которые приведены в справочнике:
DH0298 х.р = DH0сг(C2H5OH) - DH0сг(C2H4) - DH0сг(H2O) =
-1234,7 + 1422,8 = 188,1 кДж/моль.
В технике для характеристики тепловых качеств отдельных видов топлива обычно используют их теплотворную способность.
Теплотворной способностью топлива называется тепловой эффект, который соответствует сгоранию единицы массы (1 кг) для твердых и жидких видов топлива или единицы объема (1 м3) для газообразного топлива (табл. 5.2).
Таблица 5.2
Теплотворная способность и состав некоторых
распространенных видов топлива
| Топливо | Содержание, % | Теплотворная способность, кДж/г | ||
| углерод | водород | кислород | ||
| Антрацит* | ||||
| Бензин | ||||
| H2 | ||||
| Древ. уголь | - | - | ||
| Прир. газ | - | |||
| Сырая нефть | - |
* Антрацит – каменный уголь с максимальным содержанием углерода (94-96%).
Водород является наиболее эффективным химическим энергоносителем для энергетики, транспорта и технологии будущего, поскольку имеет очень высокую теплотворную способность (табл. 4.2), его относительно легко транспортировать, а при его сгорании образуется только вода, т.е. он является "чистым" горючим, не вызывает загрязнения воздуха. Однако, его широкому использованию в качестве источника энергии мешает слишком малое содержание водорода в природе в свободном состоянии. Большую часть водорода получают разложением воды или углеводородов. Однако, такое разложение требует большого расхода энергии, причем на практике из-за тепловых потерь на получение водорода приходится затратить больше энергии, чем ее потом можно будет получить. В перспективе, если удастся создать большие и дешевые источники энергии (например, в результате развития техники получения ядерной или солнечной энергии), часть ее будет использоваться на получение водорода. Многие ученые убеждены, что энергетика будущего – это водородная энергетика.
С помощью закона Гесса и его следствий можно определять многие величины, в том числе не определяемые экспериментально, если соответствующую неизвестной величине реакцию можно получить, складывая другие реакции с известными характеристиками.
Пример 2. Исходя из теплоты сгорания СН4 (DН0сг = -890кДж/моль) и Н2
(DН0сг = -286 кДж/моль), вычислить теплотворную способность газа, содержащего 60 % водорода и 40 % метана СН4.
Решение. Запишем термохимические уравнения реакций сгорания:
1) Н2 + ½О2 = Н2О(ж) ; DН0f (Н2О) = -286 кДж/моль;
2) СН4 + 2О2 = СО2 + 2Н2О(ж) ; DН02
DH02 = Н0ƒ,(CO2) + 2DН0ƒ,(Н20) - DН0ƒ,(СН4) = -393 -2.286 + 75 = -890 кДж/моль.
1м3 газа содержит 600л Н2 и 400л СН4, что составляет 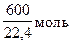 Н2 и
Н2 и 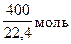 СН4. Теплотворная способность газа составит:
СН4. Теплотворная способность газа составит:
 кДж/м3.
кДж/м3.
Пример 3. Используя данные таблицы 5.1, рассчитать тепловой эффект реакции сгорания этилена: С2Н4 + 3О2 = 2СО2 + 2Н2О(г).
Решение. Из таблицы 5.1 выписываем значения энтальпий образования веществ, участвующих в реакции (в кДж/моль):
DH0ƒ,co2 = -393,5; DН0ƒ,с2н4 = 52,3; DН0ƒ,н2о = -241,8.
(Напомним, что энтальпия образования простых веществ равна нулю.)
Согласно следствию из закона Гесса (4.4):
DH0298 х.р = ånпрод·DН0ƒ,прод - ånисх·DН0ƒ,исх = 2DН0ƒ,со2 + 2DН0ƒ,н2о - DН0ƒ,с2н4 =
2. (-393,5) + 2. (-241,8) - 52,3 = -1322,9 кДж.
Пример 4. Исходя из теплового эффекта реакции
3СаО(т) + Р2О5 (т) = Са3(РО4)2 (т) , DН0 = -739 кДж,
определить энтальпию образования ортофосфата кальция.
Решение. По следствию из закона Гесса:
DH0298 х.р = DН0ƒ,Са3(PO4)2 - (3DН0ƒ,СаО + DН0ƒ,P2O5).
Из табл. 4.1: DН0ƒ, (СаО) = -635,5; DН0ƒ, (P2O5)= -1492 (кДж/моль).
DН0ƒ,Са3(PO4)2 = -739 + 3. (-635,5) - 1492 = -4137,5 кДж/моль.
Пример 5. Написать термохимическое уравнение реакции сгорания твердой серы в N2O, если известно, что при сгорании 16 г серы выделяется 66,9 кДж тепла (предполагается, что при измерении теплоты температура продуктов снижается до температуры реагентов, равной 298 К).
Решение. Чтобы записать термохимическое уравнение, надо рассчитать тепловой эффект реакции:
S(т) + 2N2O(г) = SO2 (г) + 2N2 (г); DH0 = Х кДж.
По условию задачи известно, что при сгорании 16 г серы выделяется 66,9 кДж, а в реакции участвует 32 г серы. Составляем пропорцию:
16г - 66,9 кДж
32г - X кДж X = 133,8 к Дж.
Таким образом, термохимическое уравнение записывается так:
S(т) + 2N2O(г) = SO2 (г) + 2N2 (г) , DН0 х..р.= -133,8 кДж.
(Так как тепло выделяется, реакция экзотермическая, DН0< 0).
Пример 6. Какое количество теплоты выделится при соединении 5,6 л водорода с хлором (н. у.), если энтальпия образования хлористого водорода равна
-91,8 кДж/моль (температура продуктов и реагентов равна 25 °С).
Решение.DН0ƒ,(HCl) = -91,8 кДж/моль, это значит, что при образовании одного моля HCl из простых веществ выделяется 91,8 кДж тепла, что соответствует термохимическому уравнению:
½ Cl2 + ½ H2 = HCl , DH0ƒ = -91,8 кДж.
Из уравнения видно, что для получения 1 моль HCl расходуется 0,5 моль Н2,
т. е. 0,5·22,4 л = 11,2 л. Составляем пропорцию:
11,2 л - 91,8 кДж
5,6 л - X X = 45,19 кДж.
Ответ: выделится 45,19 кДж тепла.
Пример 7.Определить энтальпию образования оксида железа (III), исходя из трех термохимических уравнений (справочником не пользоваться):
1) Fe2O3 + 3CO = 2Fe + 3CO2 , DН01 = -26,5 кДж;
2) С(графит) + ½ O2 = CO, DН02 = -110,4 кДж;
3) СO2 = C(графит) + O2 , DН03 = + 393,3 кДж.
Решение: Запишем уравнение, тепловой эффект которого нужно определить:
4Fe + 3O2 = 2Fe2O3; DН04 = 2Х кДж.
Чтобы из первых трех уравнений получить четвертое, надо уравнение 1) умножить на (-2), а уравнения 2) и 3) – на (-6) и сложить:
1) 4Fe + 6CO2 = 2Fe2O3 + 6CO, DН01 = 2·(+26,5) кДж;
2) 6CO = 6С(графит) + 3O2, DН02 = 6·(+110,4) кДж;
3) 6C(графит) + 6O2 = 6СO2 , DН03 = 6·(-393,3) кДж;
DН04 = 2DН01 + 6DН02 + 6DН03 = +53 + 662,4 - 2359,8 = -1644,4 кДж.
Отсюда DН0ƒ (Fe2O3) = - 822,2 кДж/моль.
Дата добавления: 2016-07-05; просмотров: 8860;











