Закон действующих масс
Все химические реакции в той или иной мере обратимы, то есть не идут до конца, до полного превращения исходных веществ в продукты. В реакционной смеси всегда происходит как прямая, так и обратная реакции. По мере расходования исходных веществ скорость прямой реакции уменьшается; по мере накопления продуктов возрастает скорость обратной реакции. Когда обе скорости сравняются, установится динамическое равновесие, постоянно происходит образование продуктов и исходных веществ, при этом концентрации и исходных веществ и продуктов при данных условиях не меняются со временем. Подобное равновесие называется химическим равновесием.
Рассмотрим газофазную реакцию
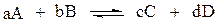
Химическое равновесие этой реакции наступает тогда, когда соотношение
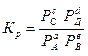 (1.16)
(1.16)
достигает определенной величины, характерной для данной реакции при данной температуре. Эта величина называется константой химического равновесия, а выражение (1.16) – законом действующих масс.
Константа равновесия связывает количества всех веществ, участвующих в реакции, и нельзя изменить количество ни одного из них, чтобы это не повлекло за собой соответствующего изменения количества веществ других участников реакции, что непременно приведет к прежнему численному значению константы равновесия. Таково содержание закона действия масс.
Численное значение константы равновесия при данной температуре не меняется с изменением исходных давлений или концентраций реагирующих веществ. Величина константы равновесия не зависит от того, какие из веществ, участвующих в реакции, взяты в качестве исходных веществ, и в каких соотношениях они введены в реакцию.
Если в реакции участвуют жидкие или твердые вещества, не образующие растворов друг с другом, то при данной температуре парциальные давления этих конденсированных участников реакции являются постоянными. Эти постоянные величины вводятся в константу равновесия. Таким образом, при записи константы равновесия учитываются только газообразные участники реакции. Так, в реакции термической диссоциации карбоната кальция по уравнению
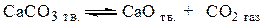
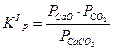
Но, поскольку 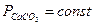 ,
, 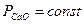 , то
, то 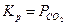
Дата добавления: 2016-06-22; просмотров: 1930;










