Химический потенциал идеального и реального газа
Основным признаком химической реакции и многих процессов в растворах является изменение состава системы. Поэтому общее изменение энергии системы при различных процессах зависит не только от термодинамических параметров (P, V, T, S и т.д.), но и от количества вещества, участвующего в процессе. Рассмотрим на примере энергии Гиббса.
Так, G = f (P, T, n1, n2, n3 …..)
При Р, Т = сonst
G = f (n1, n2, n3)
Полное изменение энергии Гиббса:
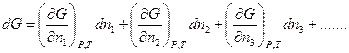
Величина 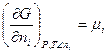 - называется химическим потенциалом.
- называется химическим потенциалом.
Химический потенциал i – го компонента – это изменение энергии Гиббса всей системы при бесконечно малом изменении количества данного газа (в расчете на 1 моль), при постоянных Р и Т и при неизменных количествах прочих газов (знак 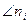 - «кроме ni»).
- «кроме ni»).
Химический потенциал индивидуального газа, 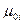 , равен энергии Гиббса одного моля этого газа,
, равен энергии Гиббса одного моля этого газа, 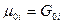 при постоянных Р и Т. Химический потенциал может быть выражен и через энергию Гельмгольца:
при постоянных Р и Т. Химический потенциал может быть выражен и через энергию Гельмгольца:

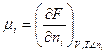
При Т = const химический потенциал зависит от давления.
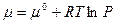 - для индивидуального газа.
- для индивидуального газа.
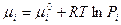 - для газа в смеси,
- для газа в смеси,
где 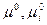 - стандартные химические потенциалы (при Рi = 1)
- стандартные химические потенциалы (при Рi = 1)
Следует отметить, что величина Р под логарифмом является относительной, то есть отнесенной к стандартному давлению 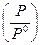 , следовательно – безразмерной.
, следовательно – безразмерной.
Если давление выражено в атмосферах, то относится к 1 атм. , если в Паскалях – к 1,0133×105 Па; если в мм.рт.ст. – к 760 мм.рт.ст. В случае реального газа вместо давления подставляем относительную фугитивность:
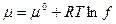 - для индивидуального газа
- для индивидуального газа
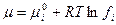 - для газа в смеси
- для газа в смеси
Дата добавления: 2016-06-22; просмотров: 1818;










