Теория поля лигандов
Теория кристаллического поля, рассматривающая только АО центрального иона в поле точечных лигандов, неприменима к p -комплексам, к донорно-акцепторным связям, к анализу деталей связывания в комплексах. Наиболее общий подход к рассмотрению электронной структуры комплексов связан с расчетами волновых функций комплекса как целого. Для координационных соединений обобщения, полученные на основе метода МО, называются теорией поля лигандов. Главная особенность ее состоит в том, что ввиду обычно высокой симметрии координационного узла МО молекулы или иона координационного соединения классифицируются по симметрийным свойствам и принципиальную схему их образования из орбиталей лигандов часто можно построить, не проводя конкретных расчетов.
МО координационных соединений с лигандами, имеющими s -орбитали.
Рассмотрим вначале случай комплексов, образуемых лигандами L типа (СН3)3Р, МН3, Н2О, ОН-, Н-, которые используют для связывания с центральным атомом металла неподеленной гибридной пары электронов или пары электронов на s-орбитали (гибрид-ион). Наиболее характерный тип координации - октаэдрический. Координационные связи в комплексе ML6к+, где М - переходный металл, образуются при донировании электронов с s -орбиталей лигандов на вакантные 3d-, 4s-, 4p-орбитали металла (для атома металла третьего периода). Чтобы рассчитать валентные МО комплекса, выберем координатные оси,как показано на рис. 11.11, расположив вдоль них лиганды.
Полный базис валентных АО состоит из 15 орбиталей: девяти - металла, шести - лигандов. Только такие комбинации лигандных АО будут формировать МО с различными орбиталями металла. Соответствующие комбинации s -АО лигандов называются групповыми орбиталями). Они представлены в табл. 3.14.
Таблица 3.14.
Валентные орбитали металла и групповые орбитали лигандов в октаэдрическом комплексе ML  (связывающие комбинации)
(связывающие комбинации)
| Металл | Лиганд | Представление симметрии |
| 4s | 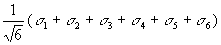
| а1g |
| 4px | 
| t1u |
| 4ру | 
| |

| ||
| 3dz2 (3dz2-x2-y2) | 
| |
| 3dx2-y2 | 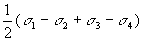
| eg |
| 3dxy, 3dxz, 3dyz | - | t2g |
Рис. 11.12,а иллюстрирует выбор групповой орбитали е-симметрии, комбинирующейся с dx2-y2-орбиталью металла. Из рис. 11.12,б ясно, почему любая комбинация s -АО лигандов дает нулевое перекрывание с d-орбиталями металла типа t2g.
На рис. 11.13 показана качественная корреляционная диаграмма МО октаэдрического комплекса, согласующаяся с данными прямых расчетов электронного строения разнообразных комплексов ML6к+. Из нее следует, что в комплексе, образованном s -лигандами и центральным атомом переходного металла, имеется шесть связывающих (a1g, tu1, 1eg) и три несвязывающих (t2g) валентных электронных уровня, на которых можно разместить 18 электронов. Если каждый из шести лигандов октаэдрического комплекса вносит по 2 s -электрона, то устойчивой конфигурацией центрального иона или атома будет 6-электронная.
В согласии с теорией кристаллического поля граничными орбиталями комплекса являются орбитали t2g и 2еg-типа. Однако если t2g-орбитали в случае комплексов с s -лигандами действительно представляют собой локализованные d-орбитали центрального атома, то 2еg-орбитали делокализованы и содержат вклад орбиталей лиганда. Поскольку эти орбитали имеют антисвязывающий характер, их заселение ведет к разрыхлению связей М-L. Так, для низкоспинового комплекса [Со(NН3)6]3+, в котором 2еg-орбитали не заселены, длины связей Со-N равны 1.94 Å, тогда как в высокоспиновом комплексе [Co(NH3)6]2+, где эти орбитали заполняются, длины связей Со-N увеличиваются до 2.11Å.
МО координационных соединений с лигандами, имеющими р- и p -орбитали.
В общем случае лиганды L, например галогены, могут образовывать связи с центральным ионом также за счет своих р-АО, оси которых ориентированы перпендикулярно связям М-L. При этом создается возможность p -связывания двух типов. На рис. 11.14, показаны два вида групповых p -орбиталей лигандов.
Групповые орбитали первого типа способны образовать p - МО комплекса при перекрывании с р-АО металла. Групповые орбитали лигандов способны к перекрыванию с t2g-AO металла. Учет p - связывания приводит к включению этих орбиталей в комплексах типа [СоF6]3- в связывающие и антисвязывающие комбинации с орбиталями лигандов, тогда как в комплексах типа [Со(NH3)6]3+ t2g – орбитали имеют несвязывающий характер. Именно этот эффект объясняет возможность образования дативных связей металла с лигандами, обусловливающих передачу электронной плотности с заполненных t2g -AO металла на вакантные р- и p *-орбитали лиганда.
Другая особенность образования связей центрального атома металла с лигандами, обладающими р-орбиталями, состоит в том, что последние образуют отдельную систему рp -орбиталей t2u-симметрии. Они вместе с s -орбиталями той же симметрии могут взаимодействовать с р-АО (t1u) центрального атома металла. Поскольку s -перекрывание намного больше, чем p -перекрывание, можно в первом приближении пренебречь p -взаимодействием и отнести рp -ряд лигандных орбиталей t1u -симметрии к несвязывающему типу. Это дает возможность рассматривать комплексы с заполненными электронами р-орбиталями (галогены) в рамках схемы, представленной на рис.11.13).
Наиболее важен эффект взаимодействия d-AO центрального атома металла с вакантными p *-орбиталями лигандов СО и СN в карбонильных и цианидных комплексах. На рис. 11.15 показана структура одной из t2g -MO гексакарбонила хрома Сr(СО)6, образующейся при перекрывании dxy-AO металла с антисвязы-вающими p *-МО оксида углерода. Центральный атом в Сr(СО)6 лежит в центре почти идеального октаэдра из атомов О и образует с лигандами как s -, так и p -связи. На рис. 11.16 дана корреляционная диаграмма МО гексакарбонила хрома, построенная с учетом p - и p *-орбиталей лиганда.
Для большей ясности s -орбитали различных типов даны в виде одного общего уровня. Расщепления, вызываемые взаимодействиями АО металла с p - орбиталями лигандов, которые можно скомбинировать в групповые орбитали, пользуясь соображениями симметрии, сравнительно малы. Как и в случае лигандов с р-орбиталями, можно рассматривать эти взаимодействия (за исключением t2g-p -взаимодействия) как второстепенные по сравнению с взаимодействиями d-s -типа. В то же время эффект примешивания p*-орбиталей лиганда к t2g-орбиталям металла играет важную роль, он приводит к увеличению расщепления t2g- eg уровней. Шесть СО-групп гексакарбонила хрома вносят 12 электронов неподеленных электронных пар, 24 p -электрона, а атом хрома дает 6 электронов. Таким образом, 21 связывающая МО в гексакарбониле хрома занята 42 электронами.
Детали химической связи в комплексных соединениях хорошо выявляют карты деформационной ЭП. Выбрав локальную систему координат на центральном атоме комплекса и сопоставляя пространственные характеристики валентных АО с положениями максимумов и минимумов d r , можно дать качественную трактовку карт d r в терминах орбитальных представлений. Такая трактовка носит, конечно, лишь приближенный характер, поскольку молекулярные (или кристаллические) орбитали не являются точной суперпозицией малого числа валентных АО.
Рассмотрим рассчитанную неэмпирическим методом Хартри-Фока в расширенном базисе стандартную деформационную ЭП гексакарбонила хрома Сг(СО)6 (рис. 3, а ). В молекуле СО, являющейся здесь лигандом, число валентных электронов равно 10 и в основном состоянии электронная конфигурация этой молекулы приведена выше (раздел 3. .). В несвязывающую s -МО больший, вклад вносит АО атома С, что проявляется на стандартной деформационной ЭП в виде положительного максимума позади этого атома (рис. 10, д). В Сr(СО)6 происходит смещение пары электронов от лиганда к иону металла через s - связь (s - донирование или донорно-акцепторная связь) и частичный обратный переток электронов к лиганду через p*-связь (обратное s - и p - донирование или дативная связь). Описанная картина хорошо согласуется с рентгеноспектральными данными.
Стандартная карта деформационной ЭП Сr(СО)6 показывает, что для s -связи, ориентированной вдоль линии Сr-СО, характерно наличие минимума d r , лежащего вблизи атома Сr и переходящего ближе к атому С в максимум. Этот максимум несколько вытянут перпендикулярно линии Сr-СО. Эти карты dr прекрасно согласуются с описанной выше картиной химической связи в Сr(СО)6. Однако специфика донорно-акцепторной химической связи на стандартной карте dr не проявляется. Выясним теперь, какая часть ЭП, аккумулируемая между атомами Сr и С, связана с образованием связи, а какая относится к неподеленным электронным парам атома С. Для этого рассмотрим “фрагментную” деформационную ЭП (рис.3. ,б) - разность между ЭП Сr(СО)6 и фрагментами Cr(CO)5 и СО при той же геометрии. Эта функция должна отражать именно донорно-акцепторное взаимодействие. И действительно, на соответствующей картее пик dr имеет существенно меньшую высоту и его максимум заметно смещен к середине межъядерного расстояния Сr-О. Он также вытянут перпендикулярно линии Сr-СО, т. е. отражает наличие p -компоненты во взаимодействии центральный атом-лиганд.
Расчет показывает, что электронные заселенности Зd орбиталей атома Сr в Сr(СО)6, показывают (табл.3.15), что t2g-AO атома Сr действительно имеют большую заселенность, чем eg-AO.
Таблица 3.15.
Электронные заселенности орбиталей Сr в Сr(СО)6
| Орбиталь | C учетом 4s-AO | Без учета 4s-AO | Теория Хa -метод | Сферический атом |
| eg | 1.42(5) | 1.37(7) | 1.12 | |
| t2g | 3.40(5) | 3.32(8) | 3.26 | |
| Сумма | 4.82(9) | 4.69(9) | 4.38 | |
| 4s | - | -0.085 | ||
| 4px | - | - | -0.011 | - |
| 4py | - | - | -0.011 | - |
| 4рz | - | - | -0.011 | - |
Дата добавления: 2022-04-12; просмотров: 158;










