Производство азотной кислоты.
Азотная кислота по объемам производства занимает второе место, уступая только серной. Основными потребителями азотной кислоты и ее солей являются сельское хозяйство, производство синтетических красителей, производство взрывчатых веществ, при производстве комплексных минеральных удобрений и т.д.
Азотная кислота является сильной одноосновной кислотой. Существует в трех агрегатных состояниях. Чистая безводная азотная кислота малоустойчива, разлагается при обычной температуре с выделением оксидов азота.
Плотности водных растворов азотной кислоты различной концентрации при температуре 20°С представлены в таблице 1.
Таблица 1
Плотности водных растворов азотной кислоты при температуре 20°С.
| с, мас.% | ||||||
| ρ, кг/м3 |
При 0°С и 0,1013 МПа азотная кислота обладает следующими свойствами:
- относительная молекулярная масса: 63,016;
- плотность жидкой кислоты: 1549,2 кг/м3;
- вязкость жидкой кислоты: 1,105 кПа·с;
- давление насыщенного пара: 1886,5 Па;
- температура плавления: -41,6°С;
- температура кипения: 82,6°С.
Азотная кислота производится двух сортов: неконцентрированная (разбавленная или слабая) с концентрацией до 62% и концентрированная с концентрацией до 99%.
Существуют следующие основные способы производства азотной кислоты:
1. Взаимодействие природных солей азотной кислоты (в основном нитрата натрия) с серной кислотой. Данный способ описывается реакцией:
NaNO3 + H2SO4 → HNO3 + NaHSO4
Учитывая ограниченные количества природной натриевой селитры, а так же постоянно увеличивающиеся потребности в азотной кислоте, данный способ производства не может обеспечить потребностей промышленности. К тому же для получения концентрированной азотной кислоты (96-98 мас.%) необходимо сырье высокого качества (содержание селитры в руде должно быть на уровне 96%, а концентрация серной кислоты 95-97%).
2. Способ фиксации азота воздуха дуговым (высокотемпературным) способом. В результате чего образуется оксид азота NO, из которого в дальнейшем получается азотная кислота. Данный метод требует больших затрат энергии, и поэтому не получил широкого распространения.
3. Способ получения оксида азота путем окисления аммиака. Процесс получения азотной кислоты из аммиака разделяется на две стадии: окисление аммиака в окись азота и окисление NO в высшие оксиды с последующим их поглощением водой. Схему процесса можно описать следующими реакциями:
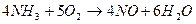
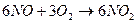
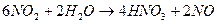
Данный способ получил название «Метод контактного окисления аммиака», который протекает в присутствии катализатора.
Дата добавления: 2017-06-13; просмотров: 1450;










