Способы получения карбамида.
Производство карбамида.
Карбамид CO(NH2)2 – диамид угольной кислоты (мочевина). Это первое органическое вещество,полученное синтетическим путем в 1868 году Велером.
По внешнему виду это белое кристаллическое вещество, уд. вес. 1,335 г/см3, температура плавления 132,40С, хорошо растворимое в воде. Например, при 200С растворимость карбамида составляет 51,8%, а при 1200С -95%. При температуре выше 1300С карбамид разлагается с выделением аммиака в газовую фазу.Химически чистый карбамид содержит 46,67% азота ().
Химическая промышленность выпускает карбамид двух марок:
Марка «А» -cодержание питатального элемента составляет 46,6%N, биурета менее 0,9%. Применяется для промышленного производства других соединений, а также в сельском хозяйстве.
Марка «Б» - содержит 46%N и 0,9% биурета.
Как минеральное удобрение, карбамид отличается от других азотных туков:
- безбаластностью;
- высоким содержанием азота (46,6%);
- пожаро и взрывобезопасностью;
- более медленно слеживается;
- менее гигроскопично.
Как амидная форма удобрения, карбамид менее подвержен вымыванию из почвы, что связано с быстрым его превращением из амидной в аммиачную форму, а последняя хорошо адсорбируется почвой. Кроме того, карбамид используется для получения сложных минеральных удобрений, а также пластмасс, лаков, клеев.
Способы получения карбамида.
Согласно литературным данным, карбамид может быть получен одним из следующих способов:
1. Из аммиака и фосгена:

2. Из аммиака и серооксида углерода:
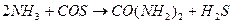
3. Гидролизом цианамида кальция - CaCN2:
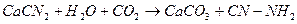
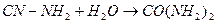
Данные способы малоэффективны, токсичны, поэтому они не нашли широкого применения в промышленности.
Основной промышленный способ, основанный на взаимодействии аммиака и углекислого газа, был разработан в 1870г. русским ученым Базаровым А.И.:
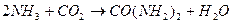




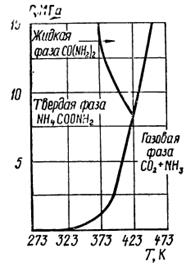
| Рис. 1. Диаграмма состояния трехфазной системы
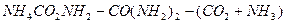
|


Таблица 1
Выход карбамида в зависимости от параметров проведения синтеза (по данным Г.Д. Ефремова, Р.О. Королева и других).
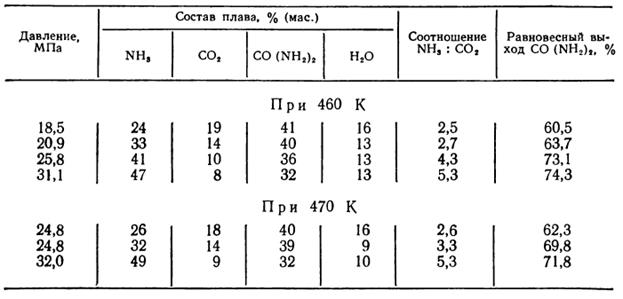
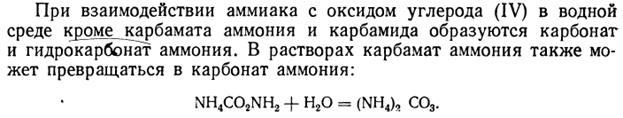

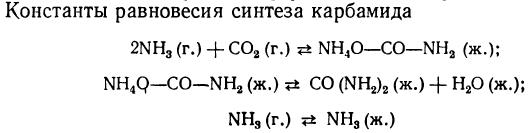
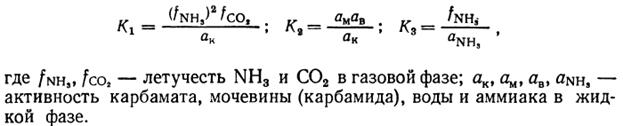
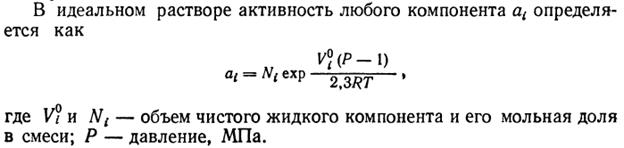
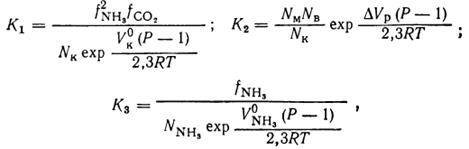
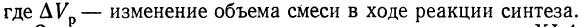

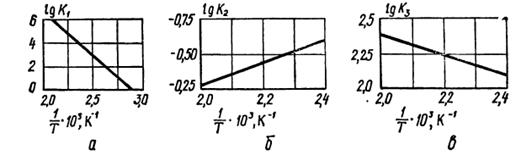
Рис. 2. Значения констант равновесия реакций синтеза карбамида.
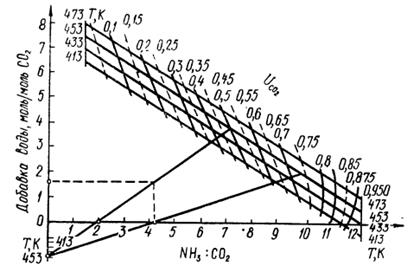
Рис. 3. Номограмма М. Фрежака для определения равновесного выхода карбамида в зависимости от температуры, мольного соотношения  и добавки воды.
и добавки воды.







Рис. 4. Диаграмма состояния системы карбамид - карбамат аммония – аммиак при: 1 – 273 К; 2 – 293 К; 3 – 313 К; 4 – 321 К; 5 – 333 К; 6 – 353 К; 7 – 373 К; 8 – 392 К; 9 – 393 К.



| <== предыдущая лекция | | | следующая лекция ==> |
| Технологические схемы производства разбавленной азотной кислоты. | | | Очистка природного газа от сернистых соединений. |
Дата добавления: 2017-06-13; просмотров: 5250;










