СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ
Сильные электролиты диссоциируют в водных растворах нацело, поэтому степень их диссоциации a должна составлять единицу, однако на практике это не наблюдается.
Измерения электропроводности и других величин показывают, что у сильных электролитов a < 1. Например, для хлорида натрия NaCl изотонический коэффициент ί должен быть равен двум, а степень диссоциации - единице. Однако измерения дают величины ί < 2 и a < 1. При сильном разбавлении раствора ί ® 2, a ® 1 (например, ί @ 2при C < 10– 4 моль/л).
При увеличении концентрации раствора сильного электролита за счет незначительных расcтояний между ионами заметно усиливается электростатическое взаимодействие между ними. В таких растворах ионы не вполне свободны, они не могут двигаться совершенно независимо друг от друга. Например, ионы Na+ тормозят перемещение ионов Cl– и обратно, что снижает их активность. Поэтому экспериментально определяемые свойства растворов электролитов средних и высоких концентраций не соответствуют представлениям об их полной диссоциации.
Это явление потребовало ввести для описания свойств растворов электролитов понятие активности (активной концентрации ионов).
Активность связана с концентрацией растворенного вещества соотношением
a = g C,
где a – активность;
g – коэффициент активности (обычно g < 1);
C – молярная концентрация, (моль/л).
Активность - это мера реального поведения вещества в растворе с учетом эффектов взаимодействия ионов между собой и с молекулами растворителя.
Коэффициент активности характеризует степень отклонения свойств данного раствора от свойств идеального раствора. Часто величину g рассматривают как «кажущуюся степень диссоциации» электролита, так как коэффициент активности, как и активность, имеет значения меньше теоретических.
Поскольку g < 1, то a < C, т. е. активность ионов меньше их концентрации и приближается к концентрации только с разбавлением электролита.
Коэффициент активности зависит от концентрации раствора, валентности, радиуса, эффективного заряда ионов, ионной силы раствора и некоторых других факторов.
Следует отметить, что коэффициент активности иона определяется ионной силой раствора. Ионная сила раствора J зависит от заряда z и концентрации С ионов и рассчитывается как полусумма произведений концентраций всех ионов на квадрат их заряда в соответствии с уравнением
J = 0,5·(z12C1 + z22C2 + ¼¼+ zn2Cn),
где z1, z2, zn и C1, C2, Cn – заряды и концентрации ионов данного вида.
Для разбавленных растворов зависимость между коэффициентом активности и ионной силой раствора выражается упрощенным уравнением
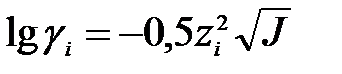
где gi – коэффициент активности иона;
zi – заряд иона;
J – ионная сила раствора.
Пример 1. Определим ионную силу раствора, содержащего 0,005 моль/л HCl и 0,001 моль/л СаСl2. Рассчитаем активности ионов H+, Cl- , Са2+.
Диссоциация электролитов происходит в соответствии с уравнениями
HCl ® H+ + Cl – ,
СаCl2 ® Са2+ + 2Cl –.
Концентрации С и заряды z ионов равны:
для H+ С1 = 0,005 моль/л, z1 = +1;
для Са2+ С2 = 0,001 моль/л, z1 = +2;
для Cl – С3 = 0,007 моль/л, z1 = –1.
Согласно уравнению получаем величину ионной силы раствора
J = 0,5 · [12·0,005 + 22 · 0,001 + (–1)2 · 0,007] = 0,008
Рассчитываем коэффициенты активности ионов.
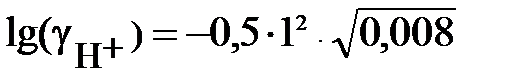 = – 0,5×1×0,089 = – 0,045;
= – 0,5×1×0,089 = – 0,045; 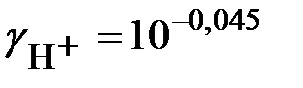 = 0,902;
= 0,902;
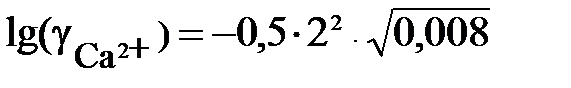 = – 0,5×4×0,089 = – 0,178;
= – 0,5×4×0,089 = – 0,178; 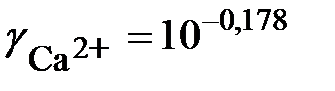 = 0,664
= 0,664
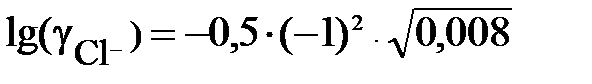 = – 0,5×1×0,089 = – 0,045;
= – 0,5×1×0,089 = – 0,045; 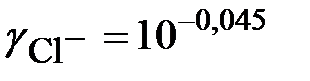 = 0,902.
= 0,902.
Находим активности ионов.
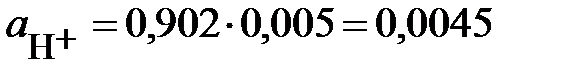 ;
;
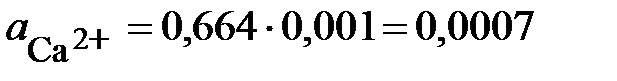 ;
;
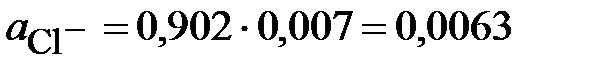 .
.
Дата добавления: 2019-12-09; просмотров: 244;










