Порядок записи уравнений гидролиза
1. Записываем уравнения реакции диссоциации соли и воды: катион под катионом, а анион под анионом
2. Так как причиной гидролиза является образование слабых электролитов (молекул или ионов), объединим ионы соли и воды по диагонали, при этом хотя бы одна образовавшаяся частица должна быть слабым электролитом, рассчитаем алгебраически суммарный заряд этой частицы ( количество ионов 1:1) и запишем ее в скобках или запомним ее формулу:
 ZnBr2ßà Zn2+ + 2Br- Na2CO3 ß-à 2Na+ + CO32- (HCO3-)
ZnBr2ßà Zn2+ + 2Br- Na2CO3 ß-à 2Na+ + CO32- (HCO3-)
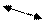
H2O ßà H+ + OH— (ZnOH+) HOH ßà H+ + OH—
Сильные электролиты по диагонали сразу представляем в молекулярной форме: HBr, NaOH, (например, H2SO4, Ba(OH)2 – в других случаях)
3. Записываем уравнения в следующем порядке: молекулярное уравнение, полное ионное, сокращенное ионное.
• Гидролиз по катиону для бромида цинка:
1 ступень
ZnBr2+ HOH ßà HBr + ZnOHBr
гидроксобромид цинка или
бромид гидроксоцинка
Zn 2+ +2Br-+ HOH ßà H + + Br- + ZnOH + + Br—
Zn 2+ + HOH ßà H + + ZnOH + ;
катион гидроксоцинка
гидролиз прошел по катиону;
среда кислая, т.к. освободился
катион водорода из воды;
рН < 7
После усиления гидролиза возможно протекание реакции по второй ступени.
Условия усиления гидролиза:
1. Так как процесс диссоциации воды эндотермический, то для лучшего распада молекул воды на ионы необходимо увеличить температуру: t 0↑;
2. Чем больше молекул воды в растворе, тем эффективнее гидролиз, то есть усиление возможно при добавлении воды или уменьшении концентрации соли: +Н2О или Ссоли↓;
3. По принципу Ле Шателье – смещения химического равновесия, достигнуть гидролиза можно выводом продуктов реакции (в частности, в данном случае связыванием полученных катионов водорода в воду путем добавления щелочи).
Итак, запишем: 1. t 0↑; 2. +Н2О или ссоли↓; 3. Вывод продуктов реакции
2 ступень:
ZnОНBrßà ZnОН+ + Br-
 |
H2O ßà H+ + OH— (Zn(OH)2
ZnOH Br+ HOH ßà HBr +Zn(OH)2
ZnOH+ +Br-+ HOH ßà H + + Br- + Zn(OH )2
ZnOH+ + HOH ßà H + + Zn(OH )2 гидроксид цинка
• Гидролиз по аниону для карбоната натрия:
1 ступень:
Na2CO3+ НОН ßà NaOH + Na HCO3
натрия гидрокарбонат
2 Na + +CO3 2--+ НОН ßà Na + + OH- + Na + + HCO3 -
CO3 2-+ НОН ßà OH- + HCO3 –
гидрокарбонат-анион
гидролиз прошел по аниону;
среда щелочная, т.к.
освободился
гидроксид-анион из воды;
рН >7
Условия усиления гидролиза: t 0↑; +Н2О или ссоли↓; Вывод продуктов реакции
2 ступень:
NaНCO3 ßà Na+ + НCO3- (H2CO3)
 |
HOH ßà H+ + OH—
Na H CO3 + НОН ßà NaOH + H2CO3
Na + +H CO3 -+ НОН ßà Na + + OH- +H2CO3
H CO3 -+ НОН ßà OH- + H2CO3
угольная кислота
Для записи уравнения гидролиза с указанием среды и иллюстрации сущности процесса достаточно сокращенного уравнения, из которого можно обратным путем прийти к полному ионному и молекулярному уравнению.
Алгоритм записи:
1. Записываем ион слабого электролита и прибавляем воду:
СО32- + HOH ßà
2. Этот ион присоединяет из воды ион с противоположным зарядом (в данном случае Н+) и высвобождает гидроксид-анион:
СО32- + HOH ßà НСО3- + ОН— (сокращенное ионное уравнение)
3. Записываем перед каждым ионом “противоион”, т.е. ион из соли с противоположным знаком, в данном случае Na+. Причем, ионов натрия пишем столько, сколько могут нейтрализовать заряды у уже написанных выше ионов:
2Na+ + СО32-- + HOH ßà Na+ + НСО3-- + Na+ + ОН—
(2+) (2-) (+) (-) (+) (-)
 | |||||||||||
 |  |  | |||||||||
 | |||||||||||
 | |||||||||||
0 0 0
4. После этого собираем все ионы в молекулы:
Na2CO3+ НОН ßà Na HCO3 + NaOH
Для гидролиза сульфата меди (П):
CuSO4 ßà Cu 2+ + SO42-

HOH ßà H+ + OH— (CuOH+)
1 ступень:
2 CuSO4 + 2HOH ßà H2SO4 + (Cu OH)2 SO4
гидроксосульфат меди (+2)
2 Cu 2+ +SO4 2-+ 2HOH ßà 2 H + + SO4 2- + 2CuOH + + SO42—
2 Cu 2+ + 2HOH ßà 2 H + + 2CuOH + ;
сократим коэффициенты на 2:
Cu2+ + HOH ßà H + + CuOH + ;
гидролиз прошел по катиону;
среда кислая, т.к. освободился
катион водорода из воды;
рН < 7
2 ступень напишите самостоятельно.
• Гидролиз смешанного типа гидролиза (по аниону и по катиону) для ацетата аммония:
CH3COO NH4 ßà NH4 + + CH3COO- (CH3COOH)

HOH ßà H+ + OH— (NH4OH)
CH3COO NH4 + HOH ßà NH4OH + CH3COO H
CH3COO -- + NH4 + + HOH ßà NH4OH + CH3COO H
гидролиз смешанный; среда нейтральная, так как константы диссоциации уксусной кислоты и гидроксида натрия имеют близкие значения; рН = 7
• Гидролиз смешанного типа ацетата свинца (+2).
Соль образована одноосновной кислотой и двухкислотным основанием.
1 ступень:
(СH3C OO)2 Pb ßà Pb2+ + 2 СH3COO— (CH3COOH)
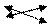
HOH ßà H+ + OH— (PbOH+)
(СH3COO)2 Pb + HOH ßà CH3COO H + PbOH ( CH3COO)
гидроксоацетат свинца (+2)
2СH3COO2-- + Pb 2+ + HOH ßà CH3COO H + PbOH+ + CH3COO__
СH3COO- + Pb 2+ + HOH ßà CH3COO H + PbOH+
катион гидроксосвинца (+2)
гидролиз смешанный,
pH – слабокислая, т.е. a и Кдисс. CH3COO H > a и Кдисс. PbOH+
(см. приложение 3)
Условия усиления гидролиза:
1. t 0↑; 2. +Н2О или ссоли↓; 3. Вывод продуктов реакции
2 ступень:
PbOH ( CH3COO) ßà PbOH+ + CH3COO- (CH3COOH)

HOH ßà H+ + OH— Pb(OH)2
PbOH ( CH3COO) + HOH ßà CH3COO H + Pb(OH)2
PbOH+ + CH3COO- + HOH ßà CH3COO H + Pb(OH)2
гидроксид свинца (+2)
сокращенного ионного уравнения в этом случае нет.
Если в случае смешанного гидролиза конечные продукты последней ступени представляют собой осадок и газ, то такой гидролиз идет до конца необратимо (мгновенный гидролиз):
Al2 S3 + 6 HOH à 2 Al(OH)3 ↓ + 3 H2S ↑
сульфид гидроксид сероводород
алюминия алюминия
2Al3+ + 3S2- + 6 HOH à 2 Al(OH)3 ↓+ 3 H2S ↑
сокращенного уравнения нет.
Степень гидролиза
Процесс гидролиза количественно характеризуют степенью гидролиза. Под степенью гидролиза понимают отношение числа гидролизованных молекул к общему числу растворенных молекул:
Число гидролизованных молекул
 h = ·100%
h = ·100%
Число растворенных молекул
Степень гидролиза зависит от температуры, концентрации соли, добавления или вывода продуктов гидролиза из сферы реакции.
Степень гидролиза повышается:
• при увеличении температуры;
• при добавлении воды (уменьшении концентрации соли);
• при выводе продуктов из сферы реакции (если в результате гидролиза среда кислая - гидролиз по катиону, то катионы водорода выводят добавлением щелочи – гидроксид анионов; если в результате гидролиза среда щелочная - гидролиз по аниону, то гидроксид-анионы выводят добавлением кислоты – катионов водорода).
Таким образом, чтобы гидролиз прошел по всем ступеням, необходимо его усилить.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Основные источники:
1. Пустовалова Л.М., Никанорова И.Е.Неорганическая химия. Ростов-н/Д. Феникс, 2012 г, 448 с. Гриф МО РФ.
Дополнительные источники:
1. Н.П. Глинка. Общая химия. – М.: Интеграл-Пресс, 2008 г, 240с.
Интернет – ресурсы:
1. www.hemi.nsu.ru
2. www.xumuk.ru
Дата добавления: 2016-10-26; просмотров: 2914;










