Глава 7. Основы химической кинетики
Основные понятия химической кинетики
Термодинамика изучает только состояния систем, она не прослеживает подробно путь реакции, поэтому она определяет лишь потенциальную возможность ее протекания в определенном направлении. В уравнениях термодинамики нет такой величины как время, поэтому она не может описать скорости процессов. Скорость реакции не связана со значением энергии Гиббса (ΔG). Например, термодинамическая вероятность реакции окисления водорода до воды
Н2 + ½О2 = Н2О (ж) , ΔG0298 = -237,2 кДж/моль,
значительно выше, чем вероятность реакции нейтрализации с образованием воды
Н+ + ОН- = Н2О (ж); ΔG0298 = -79,9 кДж/моль.
Однако первая реакция в обычных условиях без катализатора практически не идет, а вторая реакция протекает мгновенно.
Кинетика - наука о скоростях и механизмах процессов. Химическая кинетика изучает скорости и механизмы химических реакций.
Скорость химической реакции (Vх.р)выражается изменением концентрации какого-либо реагента или продукта в единицу времени:
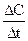 (Dt ® 0) =
(Dt ® 0) = 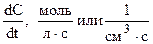 .
.
При этом скорости изменения концентраций всех продуктов и реагентов однозначно связаны между собой. Для реакции
аА + bВ + .... = сС + dD + ...
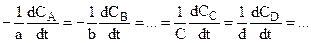
Под механизмом реакциив кинетике понимают путь реакции, то есть подробное изменение координат всех частиц в ее ходе, сближение
и удаление атомов и радикалов, повороты молекул и их частей, разрыв и образование новых химических связей. В ходе изменения координат атомов происходит изменение энергии.
Механизм химической реакции удобно описывать с помощью кривых потенциальной энергии (КПЭ)в координатах энергия (Е) - путь реакции (q); (на самом деле реакция описывается поверхностью потенциальной энергии -ППЭ в многомерном пространстве координат всех атомов системы).
На рисунке 5.1 показана схематично КПЭ для реакции реагент ® продукт (кривая 1). Видно, что ход реакции описан максимально подробно; на КПЭ есть минимумы (реагенты и продукты) и максимум - для промежуточного переходного состояния. Такие максимумы - энергетические барьеры (Еа) на пути реакции, причем они разные для прямой и обратной реакции, так что
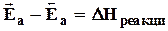 .
.
Здесь Еа - величины энергетических барьеров, которые называют энергиями активации. Это выражение дает связь между кинетикой (Еа – кинетический параметр) и термодинамикой (DН) реакции.
Ключевым утверждением химической кинетики является положение о том, что реакции происходят в результате столкновенийатомов или молекул реагентов; часть столкновений приводит к реакции.
Кривая 1, изображенная на рисунке 5.1, относится к случаю простой (элементарной) реакции, то есть реакции, которая проходит в одно столкновение и в которой не образуются промежуточные устойчивые соединения. Кривая 2 соответствует сложной реакции, протекающей через две стадии (два барьера) и через один промежуточный устойчивый продукт (минимум в середине кривой).
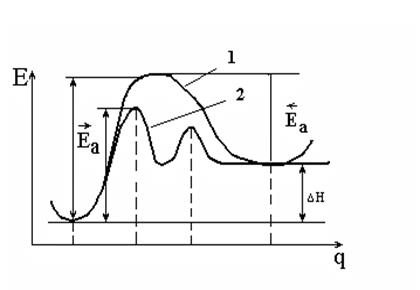
Рис. 5.1. Кривая потенциальной энергии для элементарной (1)
и сложной (2) химической реакции
На скорость реакции влияют многие факторы: концентрация реагентов, температура, давление, катализаторы, внешние воздействия, например излучения и др.
Дата добавления: 2016-07-05; просмотров: 2156;










