Например, для обратимой реакции
 аА + bВ сС + dD
аА + bВ сС + dD
закон действующих масс имеет вид
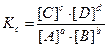
или, если вещества – газы,
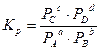 ,
,
где [A], [В] и т. д. – равновесные концентрации веществ (моль/л);
РА, РВ и т.д... – парциальные давления газов.
 Например, для реакции 2СН4 (г) С2Н2 (г) + 3Н2 (г)
Например, для реакции 2СН4 (г) С2Н2 (г) + 3Н2 (г)
закон действующих масс имеет вид
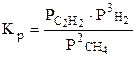 или
или 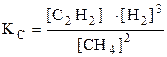 .
.
Если все реагенты газообразны и их поведение подчиняется законам идеальных газов, то связь между КР и КС можно выразить уравнением:
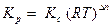 ,
,
где Δn - изменение числа молей газов в результате реакции; так что для рассматриваемой реакции
Δn = (1 + 3) - 2 = 2 и 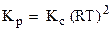 .
.
Константа равновесия обладает тем свойством, что она не зависит от концентрации реагентов и продуктов. Это значит, что увеличение концентрации одного из веществ приводит к такому изменению концентрации других веществ, что константа равновесия остается неизменной. Если увеличить [A], то [B] уменьшится, а [C] и [D] увеличатся. В то же время константа равновесия зависит от температуры: с увеличением температуры она увеличивается для эндотермических и уменьшается для экзотермических реакций.
В выражение ЗДМ включаются только концентрации растворов, концентрации или давления газов; конденсированные вещества в собственной фазе (Н2Ож, КСlт и т.п.) в формулу не включаются. Например, для реакции
Fe2O3 (т) + 3H2 (г) = 2Fe (т) + 3H2O (ж) ; 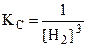 .
.
Так как Fe2O3 , Fe и H2O - конденсированные вещества, то равновесие реакции зависит только от концентрации Н2.
Константа равновесия - важнейшая термодинамическая характеристика реакции. По величине константы равновесия (К) можно судить о степени протекания реакции. При очень большом значении К равновесие реакции сильно сдвинуто вправо (в сторону продуктов), а при очень низком значении К реакция протекает в очень незначительной степени и равновесная смесь содержит преимущественно реагенты. Кроме того, по величине К можно вычислять концентрации реагентов и продуктов при достижении равновесия и, как будет показано ниже, DG реакции.
Дата добавления: 2016-07-05; просмотров: 1713;










