Электрокинетические явления
Различают 4 вида электрокинетических явлений: электрофорез, электроосмос, потенциал протекания (течения), потенциал седиментации (оседания).
Под действием внешнего электрического поля наблюдаются два явления:
1. перемещение частиц дисперсной фазы относительно неподвижной дисперсионной среды – электрофорез.
2. перемещение дисперсионной среды относительно неподвижной дисперсной фазы – электроосмос.
Явления, обратные электрофорезу и электроосмосу.
1. Возникновение разности потенциалов при перемещении дисперсной фазы относительно неподвижной дисперсионной среды – потенциал седиментации (оседания).
2. Возникновение разности потенциалов при перемещении дисперсионной среды относительно неподвижной дисперсной фазы – потенциал протекания.
Причиной электрокинетических явлений является образование двойного электрического слоя и, как следствие, наличие электрического заряда, как у частиц дисперсной фазы, так и у частиц дисперсионной среды.
Значение электрофореза, электроосмоса
Электрофорез используют в клинических исследованиях для диагностики многих заболеваний, для разделения аминокислот, нуклеиновых кислот, антибиотиков, ферментов, форменных элементов крови, для определения чистоты белковых препаратов, для введения лекарственных препаратов.
Кроме того в медицине электрофорез применяют для введения лекарственных препаратов. На кожу пациента накладывают тампон, смоченный раствором лекарственного препарата, а сверху электроды, к которым приложен низкий, безопасный для организма потенциал. Частички лекарственного препарата под действием электрического поля переходят в ткани организма.
Электроосмос используют для обезвоживания различных пористых материалов. Влажную массу помещают между электродами, а вода под действием электрического поля в зависимости от структуры ДЭС перемещается к одному из электродов и собирается в специальные емкости.
Скорость электрофореза (электрофоретическую активность) рассчитывают по уравнению Гельмгольца-Смолуховского:
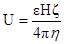
где
U – скорость электрофореза (электрофоретическая подвижность)
ε – диэлектрическая проницаемость среды
ξ – электрокинетический потенциал
H – напряженность электрического поля
η – вязкость среды
Напряженность электрического поля выражается отношением разности потенциалов к расстоянию между электродами:
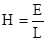
Тогда
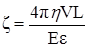
Устойчивость дисперсных систем
Под устойчивостью дисперсной системы понимают ее способность сохранять во времени
- средний размер частиц
- их равномерное распределение в среде
Для дисперсных систем различают два вида устойчивости – кинетическую (седиментационную) и агрегатную.
Кинетическая (седиментационная) устойчивость характеризует способность частиц дисперсной фазы находиться во взвешенном состоянии и не оседать под действием сил тяжести.
Агрегатная устойчивость характеризует способность частиц дисперсной фазы противодействовать их слипанию между собой и тем самым сохранять неизменными свои размеры.
Коллоидные растворы по устойчивости занимают промежуточное положение между грубодисперсными системами и истинными растворами. Коллоидные растворы обычно представляют собой седиментационно устойчивые системы, что обусловлено
1. малыми размерами частиц
2. их интенсивным броуновским движением
К факторам агрегативной устойчивости относится следующее:
1. наличие электрического заряда частиц препятствует их слипанию
2. способность к сольватации противоионов диффузного слоя; образующиеся на поверхности частиц защитные слои из сольватированных противоионов также препятствуют их слипанию
3. адсорбция на поверхности веществ ПАВ (поверхностно-активных веществ); вокруг “гидрофильных головок” ПАВ ориентируются диполи воды, в результате формируется адсорбционно-сольватный слой, препятствующий слипанию. Данное явление называется - “коллоидная защита”
4. вязкость среды: чем больше вязкость, тем меньше скорость частиц, меньше возможности для столкновения и седиментации.
Нарушение устойчивости дисперсных систем приводит к возникновению коагуляции, а в дальнейшем к седиментации частиц дисперсной фазы.
Коагуляция
Коагуляцией называется процесс слипания коллоидных частиц с образованием более крупных агрегатов из-за потери коллоидным раствором агрегативной устойчивости.
Коагуляцию могут вызвать различные внешние воздействия:
1. добавление небольших количеств электролита
2. концентрирование коллоидного раствора
3. изменение температуры
4. действие ультразвука
5. действие электромагнитного поля
6. встряхивание, перемешивание и т.д.
В биологических системах наибольшее практическое значение имеет коагуляция электролитами, т.к. коллоидные растворы клеток и биологических жидкостей находятся в соприкосновении с электролитами.
Для каждого электролита необходима своя минимальная концентрация, называемая порогом коагуляции или пороговой концентрацией (СПК).
Величина, обратная порогу коагуляции, называется коагулирующей способностью:
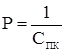
Существуют следующие правила коагуляции электролитами:
1. Коагуляцию вызывают ионы, которые имеют знак заряда, противоположный знаку заряда гранул. Коагуляцию положительно заряженных золей вызывают анионы, отрицательно заряженных – катионы.
2. Коагулирующее действие ионов тем сильнее, чем выше заряд иона – коагулянта (правило Шульце-Гарди)
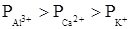 лиотропный ряд катионов
лиотропный ряд катионов
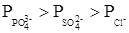 лиотропный ряд анионов
лиотропный ряд анионов
3. Для ионов одного заряда коагулирующая способность зависит от радиуса сольватированного иона: чем больше радиус, тем меньше коагулирующая способность.
Следовательно, для катионов щелочных металлов можно записать следующий лиотропный ряд:
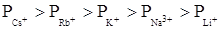
Для анионов:
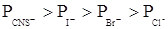
В механизмах коагуляции роль электролитов заключается в том, что:
1. может происходить уменьшение заряда поверхности твердой фазы (заряда поверхности ядер), т.е. за счет снижения межфазного (электротермодинамического) потенциала E.
2. может происходить уменьшение толщины диффузного слоя при неизменном заряде поверхности ядер.
В связи с этим различают следующие теории коагуляции:
1. адсорбционная (химическая) теория Фрейндлиха
2. физическая теория коагуляции ДЛФО (Б. В. Дерягина, Л.Д. Ландау, Э. Фервея, Дж. Т. Овербека)
1. Согласно теории Фрейндлиха коагуляция происходит под действием электролита, который химически взаимодействует с потенциалопределяющими ионами, связывая их в прочное соединение (например, переводя в осадок).
Так, при добавлении к положительно заряженному золю иодида серебра AgI сульфида калия K2S между коагулирующими анионами S2- и потенциалопределяющими катионами Ag+ происходит реакция: 2Ag+ + S2- → Ag2S↓. В результате величина межфазного потенциала падает, число противоионов, необходимых для компенсации заряда ядер также уменьшается, а, следовательно, уменьшаются и гидратные оболочки вокруг ионов, что и приводит к слипанию частиц, т.е. к коагуляции. Кроме того, снижение величины межфазного потенциала влечет и уменьшение ξ-потенциала, т.е. уменьшение заряда частиц, что приводит к падению устойчивости, т.е. к коагуляции.
2. Согласно теории ДЛФО коагуляция наступает под действием электролита, который химически не взаимодействует с ПОИ и не изменяет заряд ядра.
В этом случае коагулирующее действие проявляют те ионы добавленного электролита, которые являются противоионами для данных мицелл.
Повышение концентрации электролита приводит к уменьшению диффузного слоя. Межфазный потенциал при этом остается неизменным, однако происходит уменьшение ξ-потенциала.
Например: при добавлении нитратов к положительно заряженному золю иодида серебра AgI, мицеллы которого содержат противоионы NO3-
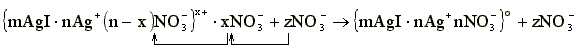
По мере увеличения концентрации добавляемых ионов NO3- они способствуют внедрению противоионов из диффузного слоя в слой адсорбционный. Диффузный слой сжимается и может наступить такое состояние, при котором диффузный слой совсем исчезнет и гранула станет электронейтральной, т.е. она будет находиться в изоэлектрическом состоянии.
Изоэлектрическим состоянием называется состояние коллоидных частиц, при котором электрокинетический потенциал (ξ) равен 0 и, которое характеризуется отсутствием направленного движения гранул в электрическом поле.
Кинетика коагуляции
В агрегативно-устойчивом состоянии коллоидного раствора значение ξ-потенциала колеблется в пределах 50-70 мВ. При уменьшении ξ-потенциала под действием электролита до 25-30 мВ в системе не наблюдается никаких внешних изменений (помутнения или изменения окраски), так как скорость коагуляции очень низкая, вследствие чего эта стадия (I) называется “скрытой” коагуляцией (рис).
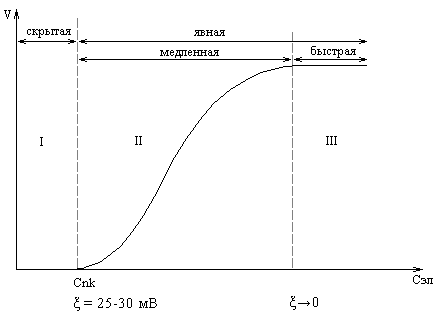
рис. Влияние концентрации электролита на скорость коагуляции
Дальнейшее добавление электролита ( > Сnn) сопровождается помутнением раствора и начинается “явная” коагуляция. Вначале скорость коагуляции быстро увеличивается (стадия II), а затем становится постоянной, когда значение ξ-потенциала станет равным 0 и наступит стадия быстрой коагуляции (III).
Коагуляция смесями электролитов
Существуют 3 возможных варианта взаимодействия между электролитами: аддитивное действие, антагонизм и синергизм.
Аддитивность – это суммирование коагулирующего действия ионов, вызывающих коагуляцию.
Аддитивное действие наблюдается в тех случаях, когда электролиты, содержащие коагулирующие ионы, химически не взаимодействуют между собой.
Например, смесь солей KCl, NaNO3 проявляет аддитивное действие по отношению и к отрицательно заряженным золям (коагуляцию вызывают K+, Na+), и к положительно заряженным золям (коагуляцию вызывают Cl-, NO3-).
Антагонизм – это ослабление коагулирующего действия одного электролита в присутствии другого.
Антагонизм проявляется в том случае, когда в результате химической реакции между электролитами коагулирующие ионы связываются в нерастворимые соединения (выпадают в осадок) или в прочный комплекс, который не обладает коагулирующей способностью.
Например, коагулирующее действие катионов Pb2+ по отношению к отрицательным золям ослабляется в присутствии NaCl, т.к. протекает реакция
Pb2+ + 2Cl- = PbCl2↓
Синергизм – это усиление коагулирующего действия одного электролита в присутствии другого.
Синергизм возможен, если между электролитами происходит химическое взаимодействие, в результате которого образуется многозарядный ион.
Например, коагулирующее действие FeCl3 и KCNS по отношению к положительным золям (коагулирующие ионы Cl-, CNS-) усиливается, т.к. происходит реакция
FeCl3 + 6KCNS = K3[Fe(CNS)6] + 3KCl
и образуются ионы [Fe(CNS)6]3-, обладающие высокой коагулирующей способностью.
Используя электролиты в медицине, необходимо учитывать возможность коагуляции в биологических средах, так например при введении различных лекарственных веществ в организм в виде инъекций следует знать, не являются ли эти вещества синергистами, чтобы избежать возможной коагуляции.
Гетерокоагуляция
Гетерокоагуляцией называется коагуляция коллоидных растворов, содержащих разнородные частицы, отличающиеся по химической природе, знаку или величине заряда.
Частным случаем гетерокоагуляции является взаимная коагуляция – слипание разноименно заряженных коллоидных частиц. При этом коагуляция происходит тем полнее, чем полнее нейтрализуются заряды коллоидных частиц (заряды гранул).
Пептизация
Пептизацией называют процесс, обратный коагуляции – процесс превращения осадка, образовавшегося в результате коагуляции, в устойчивый коллоидный раствор.
Пептизацию на практике осуществляют двумя способами:
1. Промывание осадка чистым растворителем (дисперсионной средой), что приводит к вымыванию ионов, вызывающих коагуляцию.
2. Добавление специального электролита – пептизатора, ионы которого, адсорбируясь на поверхности частиц, восстанавливают ионные атмосферы вокруг частиц.
Условия, необходимые для проведения пептизации:
1. К пептизации способны только свежеполученные осадки, т.к. длительное хранение приводит к срастанию частиц осадка, к его постепенному уплотнению и вытеснению из его структуры жидкой фазы.
2. Добавление небольших количеств электролита (иначе наступает коагуляция)
3. Перемешивание раствора
Коллоидная защита
Коллоидной защитой называется повышение агрегативной устойчивости лиофобных золей при добавлении к ним ВМС.
Механизм защитного действия заключается в том, что в водных коллоидных растворах дифильные молекулы ВМС, адсорбируясь на поверхности коллоидных частиц, ориентируются таким образом, что их гидрофобные участки обращены к частицам дисперсной фазы, а гидрофильные – к воде. В результате поверхность частиц становится лиофильной и покрывается дополнительной сольватной оболочкой.
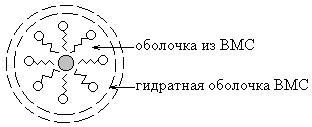
По отношению к водным коллоидным растворам защитным действие обладают хорошо растворимые в воде белки. Так, белки крови препятствуют выпадению в осадок и выделению на стенках кровеносных сосудов холестерина и солей кальция.
Коллоидная защита используется при получении устойчивых лиофобных золей, применяемых в качестве лекарственных препаратов. Например, колларгол и протаргол содержат высокодисперсное металлическое серебро, защищенное высокомолекулярными соединениями.
Дата добавления: 2016-06-22; просмотров: 2155;










