Изотермы Ван-дер-Ваальса и их анализ
После соответствующих преобразований уравнение (12.4) примет вид
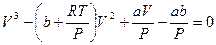 (12.6)
(12.6)
При постоянной температуре Т уравнение (12.6) устанавливает связь между давлением Р и объемом V. Это уравнение 3-й степени относительно V, а значит, имеет 3 корня, из которых вещественными могут быть все три или один (еще два – комплексно-сопряженных). В данном случае при положительных давлениях Р все три корня вещественные и положительные.
Кривые P = f(V) при разных значениях Т называются изотермами Ван-дер-Ваальса. На рис. 12.2 показана одна из таких изотерм.
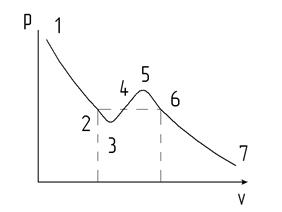
Рис. 12.2
Выясним физический смысл различных участков изотерм Ван-дер-Ваальса. Участки 7-6 и 2-1 имеют нормальный характер, т.е. давление возрастает при уменьшении объема.
Участок 5-3 соответствует неестественному поведению газа, когда его сжатие приводит к уменьшению давления.
Участки 6-5 и 3-2 отвечают метастабильным состояниям переохлажденного пара и перегретой жидкости.
Реальная экспериментальная изотерма отличается от теоретической тем, что участок 6-2 соответствует прямой линии, параллельной оси V. С повышением температуры эта прямая уменьшается и стягивается в точку К, называемую критической. Этой точке соответствуют критические параметры (РK, VK, TK). Критические параметры можно связать с поправками а и b, входящими в уравнение Ван-дер-Ваальса. При Т = ТК и Р = РК уравнение (12.6) примет вид
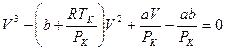 (12.7)
(12.7)
и все три корня будут одинаковы и равны критическому объему VK. В этом случае (12.7) тождественно уравнению
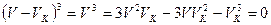 (12.8)
(12.8)
Значит коэффициенты при одинаковых степенях V в уравнениях (12.7) и (12.8) равны
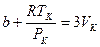
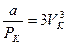
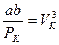
Отсюда
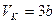
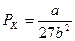
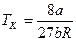 .
.
Экспериментальные изотермы при разных температурах показаны на рис.12.3.
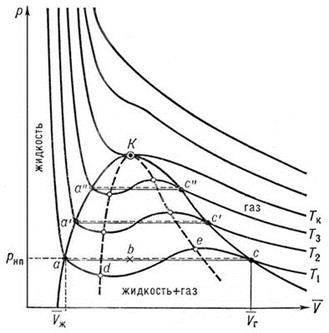
Рис.12.3.
Точка К точкой перегиба критической изотермы, выше которой находятся монотонные изотермы. Если соединить между собой точки начала и конца прямолинейных отрезков изотерм, то на диаграмме P и V получим кривую фазового равновесия жидкости и пара. За этой кривой под критической изотермой справа – область, соответствующая пару, слева – жидкости.
Область над критической соответствует газообразному состоянию. Пар отличается от газообразного состояния тем, что он при сжатии превращается в жидкость. Газ же при температуре, выше критической ни под каким давлением не может быть сжижен. Так целый ряд газов (O2, N2, H2, He2) не поддавался сжижению. Д.И.Менделеев объяснил все эти неудачи тем, что сжижение производилось при температуре больше критической.
12.3. Внутренняя энергия реального газа.
Эффект Джоуля-Томсона
Как уже говорилось выше, для реального газа необходимо учитывать силы взаимодействия между молекулами. Силы притяжения между ними приводят к внутреннему давлению
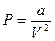 (12.9)
(12.9)
Тогда работа, затрачиваемая на преодоление сил притяжения пойдет на увеличение потенциальной энергии межмолекулярного взаимодействия dEn, т.е.
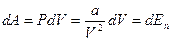 (12.10)
(12.10)
Откуда 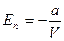 .
.
Внутренняя энергия реального газа складывается из суммы кинетической и потенциальной энергии всех молекул газа
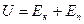 или
или 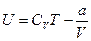 (12.11)
(12.11)
где CV – молярная теплоемкость при постоянном объеме.
При расширении газа без теплообмена с окружающей средой (адиабатически) и совершения внешней работы, т.е. dQ = 0 и dA = 0 согласно I началу термодинамики dU = 0 (т.е. U1 = U2) при равенстве внутренних энергий двух состояний газа
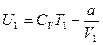 и
и 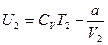 (12.12)
(12.12)
получим
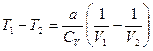 (12.13)
(12.13)
Из (12.13) видим, что при адиабатическом расширении в вакуум газа V2 > V1 его температура уменьшается T1 > T2 (газ охлаждается) и, наоборот, при адиабатическом сжатии реальный газ нагревается.
Это явление было впервые изучено Джоулем, и позднее Томсоном, поставившим соответствующие эксперименты; явление носит название эффекта Джоуля-Томсона. Схема, поясняющая этот эффект показана на рис. 12.4.
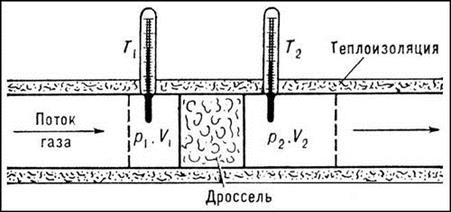
Рис.12.4
Под давлением Р1 > Р2 газ из левой части цилиндра объема V1 адиабатически проникает сквозь пористую перегородку в правую часть цилиндра V2 > V1. На основании закона сохранения энергии
U1 + P1V1 = U2 + P2V2 или U1 – U2 = P2V2– P1V1 (12.13)
Если расширяясь, газ охлаждается, эффект Джоуля-Томсона называется положительным. И, наоборот, когда газ нагревается, эффект называют отрицательным. Знак эффекта зависит от разности внутренних энергий газа в начальном и конечном состояниях (U1 – U2), а эта разность зависит от поправок ( 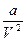 и b) в уравнении Ван-дер-Ваальса.
и b) в уравнении Ван-дер-Ваальса.
Если пренебречь 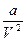 , то
, то
Р(V–b) = RT или PV = RT + bP (12.14)
и
P2V2 – P1V1 = b(P2 – P1) < 0, т.е. U1 – U2 < 0 (12.15)
а значит температура газа при адиабатическом расширении уменьшается (положительный эффект Джоуля-Томсона).
Пусть теперь b = 0. В этом случае
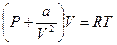 или
или 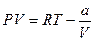 (12.16)
(12.16)
так что
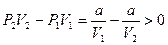 или U1 – U2 > 0 (12.17)
или U1 – U2 > 0 (12.17)
а, значит, температура газа при расширении повышается (отрицательный эффект).
Изменением давления и температуры можно вызвать изменения знака эффекта. Температура, при которой (для данного давления) эффект Джоуля-Томсона отсутствует (т.е. DТ = 0) называется температурой инверсии. Совокупность этих температур образует кривую инверсии (рис. 12.5).
Рис.12.5
Положительный эффект Джоуля-Томсона используется в холодильной технике для получения низких температур, для сжатия газа.
Дата добавления: 2019-12-09; просмотров: 465;










