Уравнение Ван-дер-Ваальса
Уравнение Менделеева-Клапейрона для одного моля идеального газа имеет вид
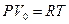 (12.1)
(12.1)
где Р – давление, V0 – объем одного моля газа, Т – температура, R – молярная (универсальная) газовая постоянная.
При выводе этой формулы мы пренебрегали объемом молекул и их взаимодействием. Для реального газа при увеличении плотности, его свойства отличаются от свойств идеального газа. Это объясняется тем, что играют свою роль объем, занимаемый молекулами и их взаимодействие между собой. Пусть при плотной упаковке молекул они займут объем b. Этот объем больше суммарного объема всех молекул. В уравнение (12.1) объем свободного пространства будет (V0 – b).
Действие молекулярных сил притяжения, стремящихся связать молекулы между собой эквивалентно действию добавочного давления Pi, помогающего внешнему давлению удержать газ в данном объеме, т.е. давление в уравнении (12.1) будет (Р + Pi). Тогда уравнение (12.1) преобразуется в уравнение Ван-дер-Ваальса
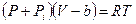 (12.2)
(12.2)
Рассмотрим, чему равно добавочное давление Pi. Пусть имеется газ, выделим мысленно слой ОО (рис. 12.1).

Рис.12.1
Сила притяжения между молекулами, а, следовательно, и добавочное давление Pi прямо пропорционально концентрации газа n0 как справа, так и слева, т.е. Pi ~ n0 × n0. ( 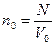 , где N – количество молекул). Тогда
, где N – количество молекул). Тогда
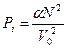 (12.3)
(12.3)
Обозначим αN2 через постоянную а, характеризующую силы молекулярного притяжения и перепишем уравнение Ван-дер-Ваальса (12.2) для одного моля газа в виде
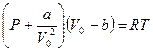 (12.4)
(12.4)
Для массы газа m уравнение примет вид
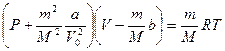 (12.5)
(12.5)
где M – молярная масса; V – объем газа; a – поправка на объем b – поправка на силы притяжения.
Дата добавления: 2019-12-09; просмотров: 245;










