Свойства ковалентной связи
ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ ВЕЩЕСТВ
Образование из атомов молекул, сложных ионов, кристаллических, аморфных и других веществ сопровождается уменьшением энергии по сравнению с невзаимодействующими (свободными) атомами. При этом минимальной энергии соответствует определённое расположение атомов друг относительно друга, которому отвечает существенное перераспределение электронной плотности (происходит изменение электронных структур взаимодействующих атомов). Силы, удерживающие атомы в молекулах и веществах, получили обобщённое название «химической связи».
Согласно предельно упрощенным теориям строения молекул, основанным на электронной теории валентности, предложенных в 1916 году, химическая связь возникает за счёт перераспределения электронов валентных орбиталей, в результате чего создаётся электронная конфигурация благородного газа (  – октет) или электронная структура
– октет) или электронная структура  за счёт образования общих электронных пар (Г. Льюис) или за счёт образования ионов (В. Коссель). Важнейшие виды химической связи: ковалентная, ионная, металлическая, водородная и межмолекулярная.
за счёт образования общих электронных пар (Г. Льюис) или за счёт образования ионов (В. Коссель). Важнейшие виды химической связи: ковалентная, ионная, металлическая, водородная и межмолекулярная.
Ковалентная связь
Ковалентная связь – наиболее общий вид химической связи, возникающей за счёт обобществления электронной пары, когда каждый из взаимодействующих атомов поставляет по одному электрону.
Механизм образования ковалентной связи рассмотрим на примере молекулы  .
.
При сближении двух атомов водорода до определённого расстояния происходит перекрытие электронных облаков атомов и образуется молекула  . Поэтому каждый атом водорода в молекуле имеет завершенную структуру
. Поэтому каждый атом водорода в молекуле имеет завершенную структуру  . В результате между ядрами атомов возникает область максимальной электронной плотности (рисунок 4.1).
. В результате между ядрами атомов возникает область максимальной электронной плотности (рисунок 4.1).
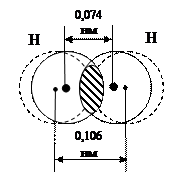 |
Рисунок 4.1 – Перекрывание электронных облаков в молекуле водорода
 Ковалентную связь можно представить:
Ковалентную связь можно представить:
а) графически 
б) в виде электронных пар 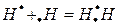
Хорошей иллюстрацией механизма образования ковалентной связи является рисунок 4.2.


Рисунок 4.2 - График изменения потенциальной энергии в зависимости от расстояния между ядрами атомов водорода
Устойчивым состоянием молекулы является такое, когда силы притяжения и отталкивания уравновешивают друг друга. Оно отвечает минимуму потенциальной энергии и характеризуется величиной равновесного расстояния между ядрами атомов (  ), а также величиной энергии связи (
), а также величиной энергии связи ( 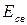 ), отвечающей минимуму на потенциальной кривой.
), отвечающей минимуму на потенциальной кривой.
Таким образом сущность ковалентной связи состоит в следующем:
- она образуется электронами с противоположно направленными спинами;
- связь тем прочнее, чем больше перекрытие электронных облаков взаимодействующих атомов.
Существуют две разновидности ковалентной связи.
Неполярная ковалентная связь, в которой общая электронная пара расположена в пространстве симметрично относительно ядер обоих атомов. Она образуется преимущественно между атомами одного и того же элемента  или между атомами, имеющими близкие значения электроотрицательностей
или между атомами, имеющими близкие значения электроотрицательностей  и т.д.) (рисунок 4.3а). Эти вещества обладают низкими температурами плавления и кипения, и в воде практически не диссоциируют.
и т.д.) (рисунок 4.3а). Эти вещества обладают низкими температурами плавления и кипения, и в воде практически не диссоциируют.
Полярная ковалентная связь, в которой общая электронная пара смещена в сторону более электроотрицательного элемента. Она образуется между атомами с различной электроотрицательностью. Например, молекула хлороводорода  :
:
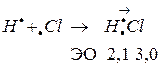
Чем больше разность величин ЭО связанных атомов, тем больше полярность связи.
Например:

Полярность связи обусловлена тем, что в результате смещения электронной плотности к атому более электроотрицательного элемента, образуется постоянный диполь: в молекуле  на атоме хлора появляется избыточный отрицательный заряд, а на атоме водорода равный по величине положительный заряд:
на атоме хлора появляется избыточный отрицательный заряд, а на атоме водорода равный по величине положительный заряд:

Схематически диполь изображается так (рисунок 4.3б):
Рисунок 4.3 а – неполярная ковалентная связь, б – полярная ковалентная связь,  – длина диполя, т.е. расстояние между ядрами атомов в молекуле.
– длина диполя, т.е. расстояние между ядрами атомов в молекуле.
Для количественной характеристики полярности связи (молекулы) вводится величина – дипольный момент  ,которая (является векторной величиной):
,которая (является векторной величиной):

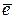 - заряд электрона, равный
- заряд электрона, равный  .
.
Дипольный момент измеряется в кулон-метрах  или в дебаях
или в дебаях  .
.
Дипольный момент молекулы равен сумме дипольных моментов всех связей в этой молекуле, а поскольку дипольные моменты векторные величины, то их сумма определяется по правилу параллелограмма.
Свойства ковалентной связи
Химическая связь, кроме энергии связи (  ) и длины связи (
) и длины связи (  ), характеризуется и другими важнейшими свойствами.
), характеризуется и другими важнейшими свойствами.
1. Кратностьопределяется количеством образованных электронных пар, связывающих атомы. Причём с увеличением кратности связи увеличивается энергия связи:

 ~
~ 

 ~
~ 

 ~
~ 
2. Насыщаемостьпоказывает, что атом образует не любое, а строго определённое количество связей, которое зависит от количества неспаренных электронов и электронных пар, способных принимать участие в образовании химических связей (например, образование связи по донорно-акцепторному механизму).
3. Направленность связи объясняется тем, что ковалентная связь предпочтительно образуется в тех направлениях, в которых возможно максимальное перекрытие атомных орбиталей. Это свойство во многом определяет пространственную конфигурацию молекул.
Дата добавления: 2016-06-05; просмотров: 2262;










