I. Ковалентная связь
Метод валентных связей (МВС), разработанный в 30-х годах прошлого столетия, объясняет образование связей между неметаллами следующим образом. Электронные облака атомов, содержащие неспаренные электроны, перекрываются и это приводит к образованию общих электронных пар, которые одновременно принадлежат двум соседним атомам. Каждый атом предоставляет на связь столько неспаренных электронов, сколько ему самому не хватает до завершения внешнего электронного слоя.
1) Ковалентная неполярная связь образуется между атомами с одинаковой электроотрицательностью ( Н2, F2, С12, O2, N2, 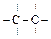 ).
).
Примеры:
а) Рассмотрим молекулу Н2.
1Н: 1s1 - атому до завершения электронного слоя, чтобы походить на инертный газ Не, не хватает одного электрона:
 или
или 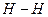
В молекуле одна общая электронная пара и кратность связи = 1.
Характер перекрывания валентных орбиталей в молекуле будет следующий:
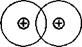
Н Н
Между атомами образуется 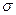 -связь.
-связь.
б) Рассмотрим молекулу F2.
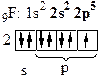
| - атому до завершения электронного слоя, чтобы походить на инертный газ Ne, не хватает одного электрона:
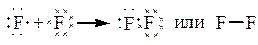
|
В молекуле одна общая электронная пара и кратность связи = 1. Характер перекрывания валентных орбиталей в молекуле будет следующий:

Между атомами образуется s -связь.
в) Рассмотрим молекулу N2.
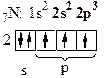
| - атому до завершения электронного слоя, чтобы походить на инертный газ Ne, не хватает трех электронов. |
Поэтому в молекуле между атомами образуется три общие электронные пары и кратность связи = 3:
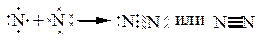
p-орбитали, на которых находится по одному неспаренному электрону, ориентированы вдоль осей х, у и z. Расположим ядра атомов N вдоль оси х; перекрывание орбиталей будет иметь различный характер и между атомами N в молекуле образуются различные связи: одна s-связь и две p-связи.
2) Ковалентная полярная связь образуется между атомами с различной электроотрицательностью. Общие электронные пары смещены в сторону более электроотрицательного элемента.
a) Молекула HF H: 1s1 (до завершения нужен 1 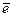 )
)
F: 1s2 2s2 2р5 (до завершения нужен 1 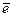 )
)
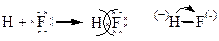 .
.
Общая электронная пара сдвинута к фтору, как к более электроотрицательному элементу:

б)Молекула NH3 H: 1s1
N:1s22s2 2р3
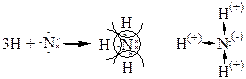
У ковалентной связи есть специфические свойства:
а) направленность: валентные орбитали перекрываются под строго определенным углом и это связано с геометрической структурой молекул - см. линейную молекулу, пирамиду, тетраэдр.
По характеру перекрывания орбиталей связи также подразделяют на s, p, d, j.
s-связи: .
1) самые прочные;
2) имеют 1 область перекрывания;
3) эта область лежит между ядрами соседних атомов.
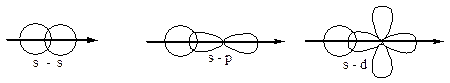
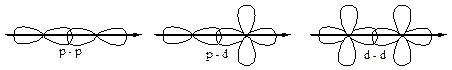
p-связи:
1) менее прочные;
2) имеют 2 области перекрывания;
3) эти области перекрывания лежат над и под линией, соединяющей ядра.

б) насыщаемость: число общих 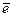 -пар не произвольно, а соответствует числу неспаренных
-пар не произвольно, а соответствует числу неспаренных 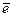 для каждого атома.
для каждого атома.
II. Донорно-акцепторная связь (по ковалентному типу)
Образуется за счёт неподеленной пары электронов одного элемента (донор 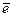 -пары) и свободной орбитали другого элемента (акцептор
-пары) и свободной орбитали другого элемента (акцептор 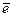 -пары).
-пары).
Пример 1:
NH3 + HCl ® NH4Cl
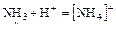
3 ковал. связи
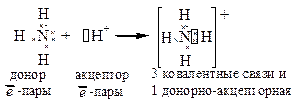
Часто донорно-акцепторную связь считают разновидностью ковалентной связи. Однако в молекулах с такими связями нарушен принцип насыщаемости (число связей больше, чем требуется по валентности).
Пример 2:
Комплексное соединение Na3[AI+3F6]-3.
АI+3 может образовать 3 ионные связи. А присоединяются к нему 6 ионов F-. Значит, наряду с ионными связями обязательно есть донорно-акцепторные:
ионы F-: 1s22s22p6 - доноры 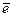 -пар;
-пар;
ион АI+3 - акцептор 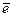 -пар;
-пар;
АI0 - З 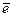 ® АI+3: 1s22s22p33s03p0.
® АI+3: 1s22s22p33s03p0.
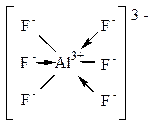
III. Ионная связь
Образуется между металлами и неметаллами, и в основе образования ионов лежит стремление атомов иметь завершённый электронный слой.
Пример:
2Na + Cl2 ® 2NaCl ; рассмотрим механизм образования связи:
 11Na0 (1s22s22p63s1)
11Na0 (1s22s22p63s1)  Na+(1s22s22p6)- оболочка, как у Ne,
Na+(1s22s22p6)- оболочка, как у Ne,
17C10 (1s22s22p63s23p5)  Cl- (1s22s22p63s23p6)- оболочка, как у Аr,
Cl- (1s22s22p63s23p6)- оболочка, как у Аr,
Na++Cl- ® NaCl (электростатическое взаимодействие)
Единичные молекулы встречаются редко, строение вещества кристаллическое. В кристаллической решетке чередуются (+) и (-) заряженные ионы:
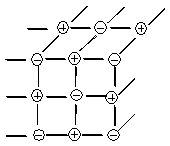
Свойства ионной связи:
а) ненаправленность - каждый ион создает вокруг себя равномерное поле, в которое с любой стороны может войти ион с противоположным зарядом;
б) ненасыщаемость - число этих ионов с противоположным зарядом в решетке довольно велико - гораздо больше, чем это требуется по валентности
(4 или 6, или 8, или 12...) - в зависимости от типа решетки.
Дата добавления: 2017-10-04; просмотров: 1314;










