Основное уравнение массопередачи
Массообменные процессы. Фазовое равновесие
В химической технологии многие процессы связаны с переходом вещества из одной фазы в другую. Такие процессы называются массообменными. Эти процессы еще называются диффузионными, поскольку такой переход обусловлен скоростью диффузии вещества.
К массообменным процессам в химической технологии относятся:
Абсорбция и адсорбция – это сорбционные процессы, связанные с разделением газовых и парогазовых смесей путем избирательного поглощения одного или нескольких компонентов. В случае абсорбции – поглотитель – жидкость. В случае адсорбции – твердый поглотитель. В случае абсорбции происходит массообмен между газом и жидкостью; в случае адсорбции – между газом и твердым телом.
Ректификация – процесс разделения жидких смесей, состоящих из нескольких компонентов, обладающих различной упругостью паров, основанный на многократном противоточном взаимодействии жидкости и пара. При ректификации происходит массо - и теплообмен между паровой и жидкой фазами.
Экстракция - процесс разделения смеси компонентов, входящих в состав твердой или жидкой фаз, путем обработки их жидким растворителем, способным полностью или частично извлекать один из компонентов. В данном случае массообмен происходит между твердой и жидкой фазами (экстракция из твердого тела) или между жидкими фазами (жидкостная экстракция).
Кристаллизация и растворение твердых веществ. При кристаллизации происходит массообмен в направлении от жидкого раствора к твердому телу – кристаллу, а при растворении – от твердого тела к жидкости (раствору).
Сушка – процесс удаления влаги из влажных материалов за счет подводимой извне тепловой энергии. При сушке происходит массопередача влаги из влажного материала в окружающую газовую среду.
Фазовое равновесие
Переход вещества из одной фазы в другую в направлении достижения равновесия называется массопередачей.
Под равновесием понимается такое состояние между фазами, когда в единицу времени из первой фазы во вторую переходят столько же молекул вещества, сколько из второй в первую.
Правило фаз. Существование данной фазы в равновесии с другими возможно лишь при вполне определенных условиях и определяется правилом фаз. Эти условия (температура, концентрация), при которых система находится в равновесии, могут меняться.
Будем называть компонентом системы каждое из находящихся в ней химических однородных веществ, которое выделяется из нее и может существовать самостоятельно длительное время. Компоненты системы, наименьшее число которых достаточно для образования всех фаз данной системы, называется независимыми компонентами.
Для процесса массопередачи на равновесие системы влияют только 2 внешних фактора – температура и давление, и правило фаз записывается следующим образом: C = K – Ф + 2,
С – число степеней свободы или минимальное число факторов, которые можно изменять независимо друг от друга без нарушения равновесия системы.
Ф – число фаз системы;K – число независимых компонентов системы.
В зависимости от числа степеней свободы, системы могут быть:
1 безвариантными – С=0;
2 одновариантными С=1;
3 двухвариантными С=2 ;
4 многовариантными С >2.
Для систем, состоящих из 2 или более числа компонентов, их состояние и равновесие зависят от температуры, Р и количественного состава фаз.
Двухкомпонентная система, состоит из двух фаз, имеет две степени свободы (С=2 – 2 + 2 = 2), т.е. для нее без нарушения равновесия фаз можно менять одновременно t-ру и Р. В том случае, если один из этих факторов принять постоянным (t-ру или Р), то состояние равновесия между фазами будет характеризоваться лишь величиной другого переменного фактора и составом фаз. Так, например, при Р=const каждой температуре будет соответствовать строго определенный состав фаз.
Закон Генри
Равновесный состав фаз в системах газ-жидкость характеризуется равновесным распределением растворимого газа между инертным газом и растворяющей жидкостью и определяется для идеальных газов по закону Генри.
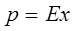 ,
,
где: р– парциальное давление газа над раствором; х – молярная доля газа в растворе; Е – константа Генри (имеет размерность давления). Закон Генри формулируется следующим образом:
Парциальное давление растворенного идеального газа пропорционально его молярной доле в растворе, или
растворимость идеального газа в жидкости при данной t-ре пропорциональна его парциальному давлению над раствором.

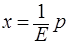 (*)
(*)
Если у* - молярное равновесное содержание растворимого газа в газовой смеси и Р – общее давление газа, то парциальное давление р будет равно:
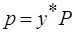 , подставим в (*), получим
, подставим в (*), получим
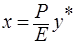 , откуда
, откуда 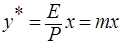 ,
,
где m – коэффициент распределения или константа фазового равновесия (безразмерная величина).
Фазовое равновесие между раствором идеального газа в жидкости и газовой смесью над ней подчиняется закону Генри только при t > t критических (для газа).
Поскольку при сильном разбавлении любой раствор приближается к идеальным, то закон Генри применим и к разбавленным растворам, при этом он работает тем точнее, чем выше разбавление.
По этой же причине закон Генри достаточно точно описывает равновесие для плохо растворимых газов.
Для газов со сравнительно высокой растворимостью закон Генри справедлив лишь при низких концентрациях; при высоких концентрациях растворимость ниже, чем это следует из закона Генри.
Закон Рауля. При температурах газа ниже критической система будет двухфазной: жидкость – насыщенный пар.
Равновесие в этом случае характеризуется составом жидкости х и составом находящегося в равновесии с жидкостью пара у*.
Равновесие фаз для жидких идеальных растворов описывается законом Рауля: – парциальное давление любого компонента в парах над смесью жидкостей равно упругости насыщенного пара этого компонента (при данной температуре) умноженной на его молярную долю в жидкости.
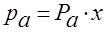 ,
,
pa– парциальное давление пара компонента а над смесью жидкостей;
Рa – давление насыщенного пара компонента а при t - ре смеси,
х – молярная доля компонента а в жидкой смеси.
Для любого компонента его парциальное давление можно определить:
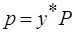 и следовательно равновесный состав пара над жидкостью:
и следовательно равновесный состав пара над жидкостью:
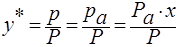 ;
; 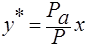
Р – общее давление паров над жидкой смесью.
Основное уравнение массопередачи
В массообменных процессах вещество путем диффузии переходит из одной фазы в другую, причем компонент, который переходит называется распределяемым веществом.
Основной характеристикой массообменных процессов является скорость массопередачи, которая представляет собой количество распределяемого вещества М(кг), переходящего из одной фазы в другую через единицу поверхности соприкосновения фаз F(м ²) в единицу времени 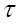 , т.е.
, т.е.
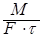
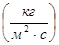 .
.
Скорость процесса массопередачи пропорциональна его движущей силе, которая равна разности концентраций
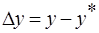 , где у– концентрация распределяемого вещества в первой фазе, откуда вещество уходит;
, где у– концентрация распределяемого вещества в первой фазе, откуда вещество уходит;
у* - концентрация распределяемого вещества у поверхности раздела фаз (со стороны первой фазы), при которой бы существовало равновесие с концентрацией второй фазы х.
Т.о. скорость массопередачи 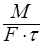 =
= 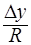 ; R-диффузионное сопротивление переносу вещества.
; R-диффузионное сопротивление переносу вещества. 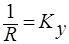 - коэффициент массопередачи. Т.к. концентрации фаз в ходе процесса меняются, то изменяется и
- коэффициент массопередачи. Т.к. концентрации фаз в ходе процесса меняются, то изменяется и 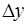 . Поэтому вводится понятие средней движущей силы
. Поэтому вводится понятие средней движущей силы 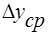 .
.
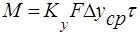 - основное уравнение массопередачи, где М-нагрузка аппарата. В условиях стационарного процесса
- основное уравнение массопередачи, где М-нагрузка аппарата. В условиях стационарного процесса 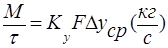 .
.
Из основного уравнения массопередачи: 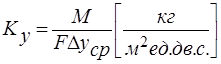 - Коэффициент массопередачи– это количество вещества, переданного из одной фазы в другую через единицу поверхности в единицу времени при движущей силе равной единице.
- Коэффициент массопередачи– это количество вещества, переданного из одной фазы в другую через единицу поверхности в единицу времени при движущей силе равной единице.
Движущая сила одного и того массообменного процесса может быть выражена разностью концентраций и по другой фазе:
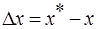 , которая будет иметь другую численную величину. Основное уравнение массопередачи в данном случае:
, которая будет иметь другую численную величину. Основное уравнение массопередачи в данном случае: 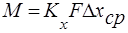 ,
,
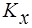 - коэффициент массопередачи, отнесенный ко 2 фазе. Он имеет другое численное значение, но тот же физический смысл. Следовательно, можно записать (поскольку слева одно и тоже значение М):
- коэффициент массопередачи, отнесенный ко 2 фазе. Он имеет другое численное значение, но тот же физический смысл. Следовательно, можно записать (поскольку слева одно и тоже значение М): 
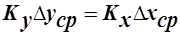 , отсюда
, отсюда 
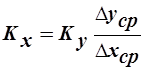 .
.
 Чаще всего в массообменных аппаратах поверхность соприкасающихся фаз практически неопределима (например: жидкость с газовыми пузырями). Поэтому основное уравнение массопередачи (ОУМП) применяют в виде
Чаще всего в массообменных аппаратах поверхность соприкасающихся фаз практически неопределима (например: жидкость с газовыми пузырями). Поэтому основное уравнение массопередачи (ОУМП) применяют в виде

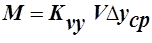 ,
, 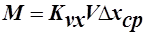 , где V-рабочий объём аппарата;
, где V-рабочий объём аппарата;
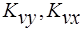 - объёмные коэффициенты массопередачи.
- объёмные коэффициенты массопередачи.
Объёмные коэффициенты массопередачи – представляют собой количество вещества переданного из одной фазы в другую в единице рабочего объёма аппарата в единицу времени при движущей силе=1.
Из основного уравнения массопередачи определяется поверхность массопередачи 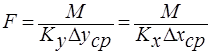 или объём рабочей зоны аппарата
или объём рабочей зоны аппарата 
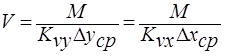 .
.
Дата добавления: 2017-10-04; просмотров: 2545;










