Твердые полупроводники.
В полупроводниках носителями заряда являются отрицательно заряженные электроны и положительно заряженные «дырки» - квазичастицы, движение которых является следствием коллективных движений электронов. Дырка как квазичастица обладает эффективной массой и подвижностью, которые зависят от кристаллической структуры полупроводника. Для того чтобы электрон из обычного при низких температурах «связанного» состояния перешел в состояние «электрон проводимости» и при этом образовалась еще и «дырка», необходима энергия активации. Эта энергия активации составляет 0,1 – 1,5 эВ. Напомним, что энергетическая мера теплового движения молекулы составляет при комнатной температуре величину kT ~ 4×10-2 эВ. С ростом температуры объемная концентрация носителей заряда в полупроводниках растет, и растет быстрее, чем уменьшается подвижность. Выражение для электропроводности беспримесного полупроводника имеет вид:
 (1)
(1)
где n – объемная концентрация электронов проводимости, p – объемная концентрация дырок,  и
и 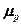 подвижность электронов проводимости и дырок, соответственно,
подвижность электронов проводимости и дырок, соответственно,  - энергия активации, k – коэффициент Больцмана, Т – абсолютная температура. Значения n и p взаимосвязаны между собой условием электрической нейтральности полупроводника в целом и тем обстоятельством, что существование связанного электрона и существование дырки как квазичастицы в одной и той же ячейке фазового пространства – это взаимоисключающие события в вероятностном описании полупроводника.
- энергия активации, k – коэффициент Больцмана, Т – абсолютная температура. Значения n и p взаимосвязаны между собой условием электрической нейтральности полупроводника в целом и тем обстоятельством, что существование связанного электрона и существование дырки как квазичастицы в одной и той же ячейке фазового пространства – это взаимоисключающие события в вероятностном описании полупроводника.
Легко видеть, что температурный коэффициент электропроводности полупроводника имеет положительную величину:
 (2)
(2)
Подробнее с электрическими явлениями в полупроводниках, в том числе и легированных, можно ознакомиться в разделе курса «Квантовая физика твердого тела».
Электролиты.
Главным свойством растворов электролитов является их свойство проводить электрический ток, что позволяет отличить такие растворы от растворов чистых компонентов. При растворении в полярном растворителе (типичный представитель – обыкновенная вода) вещества типа хлористого водорода HCl и кристаллические вещества типа соли NaCl диссоциируют на вполне устойчивые ионы с положительным и отрицательным электрическими зарядами. В растворе при этом выполняется условие электрической нейтральности.
Электрический ток в электролитах обусловлен движением положительных ионов (катионов) и отрицательных ионов (анионов) в растворе. Если диссоциация растворенного вещества и рекомбинация ионов обратимы, то к ним применимы известные законы химического равновесия. В.Ф. Оствальд (1853-1932) рассматривал растворы, в которых каждое из растворенных веществ подчиняется идеальным осмотическим законам. Для каждого из растворенных веществ справедливо соотношение:
 (1)
(1)
где  - химический потенциал растворенного вещества при концентрации С молей на литр,
- химический потенциал растворенного вещества при концентрации С молей на литр,  - химический потенциал при С=1, он зависит от температуры, давления и вида растворителя, но не от состава раствора.
- химический потенциал при С=1, он зависит от температуры, давления и вида растворителя, но не от состава раствора.
В случае одно-одновалентного электролита АВ, диссоциирующего по уравнению AB↔A+ +B 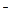 , условие равновесия сводится к уравнению:
, условие равновесия сводится к уравнению:
 (2)
(2)
Если в уравнение (2) подставить соотношение (1), то после несложных преобразований легко получить:
 (3)
(3)
Здесь  - концентрация положительных ионов в растворе,
- концентрация положительных ионов в растворе,  – концентрация отрицательных ионов в растворе, САВ – концентрация исходных молекул (не распавшихся, нейтральных) растворенного вещества в растворе. Выражение
– концентрация отрицательных ионов в растворе, САВ – концентрация исходных молекул (не распавшихся, нейтральных) растворенного вещества в растворе. Выражение
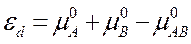 (4)
(4)
можно интерпретировать как «теплоту диссоциации», еще раз заметим, что  сильно зависит от свойств растворителя: с ростом величины диэлектрической проницаемости среды
сильно зависит от свойств растворителя: с ростом величины диэлектрической проницаемости среды 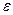 - величина
- величина  заметно падает.
заметно падает.
Введем в рассмотрение величину 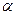 - «степень диссоциации» - как долю молекул, которые распались на ионы. Следствием такого определения являются соотношения:
- «степень диссоциации» - как долю молекул, которые распались на ионы. Следствием такого определения являются соотношения:

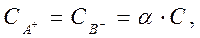 (5)
(5)
где С – концентрация растворенного вещества в растворе. Используя зависимость (1) в выражении (3), получим:
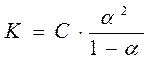 (6)
(6)
- закон действующих масс, где К – константа химического равновесия. Уравнение (6) служит для расчета степени диссоциации электролита в зависимости от концентрации раствора и природы растворителя, температуры и давления в системе. Если величина степени диссоциации известна, то рассчитать объемные концентрации положительных и отрицательных ионов труда не представляет.
Для того чтобы воспользоваться соотношением (1) раздела 8.2.1 – определение объёмной плотности тока проводимости, необходимо уметь оценить скорости движения ионов в растворе. В рамках элементарных представлений полагают, что в установившемся процессе средняя скорость  движения ионов определенного типа может быть найдена из уравнения баланса сил, действующих на отдельный ион, движущей силы электрического поля и силы сопротивления движению иона в среде. В линейном приближении это уравнение можно записать в виде:
движения ионов определенного типа может быть найдена из уравнения баланса сил, действующих на отдельный ион, движущей силы электрического поля и силы сопротивления движению иона в среде. В линейном приближении это уравнение можно записать в виде:
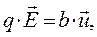 (7)
(7)
где  – напряженность электрического поля, q - заряд иона,
– напряженность электрического поля, q - заряд иона,  – некоторая постоянная.
– некоторая постоянная.
Для учёта силы сопротивления при движении ионов в растворе часто используют закон (движение шарика в вязкой среде при малых значениях скорости):

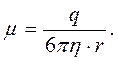 (8)
(8)
В формулах (8) 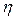 – коэффициент динамической вязкости среды, r – эффективный (условный!) радиус иона,
– коэффициент динамической вязкости среды, r – эффективный (условный!) радиус иона,  - значение подвижности иона в данном растворе.
- значение подвижности иона в данном растворе.
Более подробно вопросы протекания электрического тока в электролитах освещены в руководствах по физической химии и электрохимии.
Газы и плазма.
В обычных условиях газы состоят из нейтральных атомов или (и) молекул, такие газы практически не проводят электрический ток. Под действием космического излучения и по ряду других причин (ударная ионизация, фотоионизация, тепловая ионизация и др.) в газах могут существовать отдельно электроны, положительные ионы и отрицательные ионы.
При этом в газе возникают носители заряда, а их направленное движение и является электрическим током. Различают при этом «электронный ток» и «ионный ток». Интересно отметить, что термодинамические параметры совокупности электронов и совокупности ионов могут быть различны (речь идет, в частности, о таком параметре состояния, как температура). Ниже рассмотрим явление термической ионизации газа.
Если рассматривать газ как совершенный (идеальный) газ, то можно предположить, что распределение молекул газа по скоростям определяется формулой Максвелла:
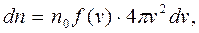 (1)
(1)
где dn – количество молекул, скорости которых лежат в пределах от v до v+dv, n0 - общее число молекул в единице объема,
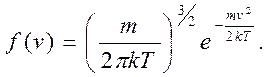 (2)
(2)
Доля молекул, обладающих энергией, которая превышает величину энергии ионизации атома  , определяется соотношением:
, определяется соотношением:
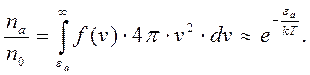 (3)
(3)
Если газ состоит из многоатомных молекул, для «развала» которых на отдельные атомы необходима энергия 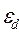 , то с повышением температуры, когда будет выполнено условие
, то с повышением температуры, когда будет выполнено условие  , газ будет существовать в форме атомов. Если для ионизации атома необходима энергия
, газ будет существовать в форме атомов. Если для ионизации атома необходима энергия 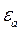 , то для полной ионизации газа необходима температура
, то для полной ионизации газа необходима температура 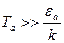 . Например, для атома водорода энергия ионизации составляет величину 13,6 эВ, что приводит к оценке Ta>157000 K. Потенциал ионизации атомов цезия 3,86 эВ, для этого случая Ta>44600 K. Понятно, что доля молекул газа при комнатной температуре (
. Например, для атома водорода энергия ионизации составляет величину 13,6 эВ, что приводит к оценке Ta>157000 K. Потенциал ионизации атомов цезия 3,86 эВ, для этого случая Ta>44600 K. Понятно, что доля молекул газа при комнатной температуре ( 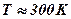 ), способных произвести ионизацию вещества ничтожно мала. В астрофизике и теории взрыва приходится рассматривать вещество в состоянии плазмы – т.е. в состоянии частично или полностью ионизованном.
), способных произвести ионизацию вещества ничтожно мала. В астрофизике и теории взрыва приходится рассматривать вещество в состоянии плазмы – т.е. в состоянии частично или полностью ионизованном.
Степень ионизации газа численно равна отношению числа имеющихся в газе заряженных частиц одного знака к сумме нейтральных и заряженных частиц данного знака:
 (4)
(4)
N –число заряженных (отрицательных) частиц, N0 - число нейтральных частиц в единице объема.
Давление частично ионизированного газа в случае малой объемной плотности газа (пренебрегаем кулоновским взаимодействием частиц) можно вычислить по формуле:
 (5)
(5)
Соображения, схожие по подходу при рассмотрении диссоциации электролитов, приводят к формуле Саха для расчета степени ионизации газа:
 (6)
(6)
здесь mi – масса иона, me – масса электрона,  – постоянная Планка, p – давление, Т – абсолютная температура.
– постоянная Планка, p – давление, Т – абсолютная температура.
При выводе формулы Саха было использовано предположение об электронейтральности вещества, о термодинамическом равновесии между атомами, ионами и электронами, о малом влиянии кулоновского взаимодействия между заряженными частицами. В реальных условиях температуры ионов и электронов могут сильно различаться.
Дата добавления: 2017-09-01; просмотров: 843;










