Общие методы получения любых кислот
Практически все кислоты могут быть получены одним из способов, приведенных ниже.
1°. Взаимодействие между солью и кислотой приводит к образованию новой соли и новой кислоты, если между солью и кислотой не протекает окислительо-восстановительная реакция, например:
а) Вытеснение слабых кислот сильными.
NaCN + HCl 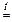 NaCl + HCN .
NaCl + HCN .
б) Вытеснение летучей кислоты из ее солей менее летучей кислотой. Для этих целей обычно используют серную кислоту, т. к. она обладает целым рядом необходимых для этого свойств:
– кислота сильная
– термически устойчивая
– мало летучая [tкип.(H2SO4) = 296,5°C]^
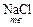 +
+ 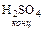 = NaHSO4 + HCl
= NaHSO4 + HCl
NaHSO4 + NaCl  Na2SO4 + HCl .
Na2SO4 + HCl .
Серная кислота способна вытеснять из солей более сильные кислоты, даже такую как хлорную — самую сильную из всех кислородных кислот.
KClO4 + H2SO4 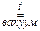 KHSO4 + HClO4.
KHSO4 + HClO4.
Однако, используя серную кислоту для этих целей необходимо учитывать и другие свойства этой кислоты, ограничивающие ее применение. Концентрированная серная кислота является достаточно сильным окислителем, поэтому ее нельзя использовать для получения таких кислот как HBr, HI, H2S, кислотообразующие элементы которых она может перевести в другие степени окисления, например:
8  +
+ 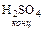 = 4I2 + H2S + 4 H2O.
= 4I2 + H2S + 4 H2O.
В этом случае можно использовать нагревание соли с фосфорной кислотой, которая не проявляет окислительные свойства:
NaBr + H3PO4  NaH2PO4 + HBr.
NaH2PO4 + HBr.
Кроме того, концентрированная серная кислота обладает достаточно сильными водоотнимающими свойствами, что приводит к разложению кислоты, вытесняемой из соли, за счет диспропорционирования центрального атома:
3 KClO3 + 3 H2SO4 = 3 KHSO4 + 2 ClO2 + HClO4 + H2O,
либо к образованию неустойчивого кислотного оксида, разложение которого может происходить со взрывом:
| 2 KMnO4 + H2SO4 = K2SO4 + H2O + | Mn2O7 ¯ | |||
| MnO2 + O2 | ||||
в) Образование одного нерастворимого продукта:
AgNO3 + HCl = AgCl ¯ + HNO3
Ba(H2PO4)2 + H2SO4 = BaSO4 ¯ + 2 H3PO4
Na2SiO3 + 2 HCl + (x-1) × H2O= 2 NaCl + SiO2 × x H2O ¯.
2°. Взаимодействие солей, гидролиз которых идет практически до конца, с водой:
Al2S3 + 6 H2O = 2 Al(OH)3 ¯ + 3 H2S .
3°. Гидролиз галогенангидридов кислот:
PBr5 + H2O = POBr3 + 2 HBr
POBr3 + 3 H2O = H3PO4 + 3 HBr
| SO2Cl2 хлорид сульфурила | + | 2 H2O горячая | = H2SO4 + 2 HCl |
| SOCl2 хлорид тионила | + H2O = SO2 + 2 HCl |
| COCl2 фосген | + | H2O горячая | 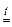 CO2 + 2 HCl . CO2 + 2 HCl .
|
4°. Окисление неметаллов азотной кислотой:
3 P + 5 HNO3 + 2 H2O = 3 H3PO4 + 5 NO
S + 2 HNO3 конц.  H2SO4 + 2 NO.
H2SO4 + 2 NO.
5°. Окисление кислотообразующего элемента до более высокой степени окисления:
H3PO3 + H2O2 = H3PO4 + H2O
3 H2SO4 + 5 H3PO3 + 2 KMnO4 = 5 H3PO4 + 2 MnSO4 + K2SO4 + 3 H2O
H2SO3 + H2O2 = H2SO4 + H2O
HNO2 + Br2 + H2O = HNO3 + 2 HBr.
Дата добавления: 2021-09-07; просмотров: 208;










