A. Повышение температуры кипения
Температуры кипения и замерзания растворов. Растворимость твердых тел. Осмотическое давление. Мембранное равновесие. Перегонка летучих жидких смесей.
Из закона Рауля вытекают важные следствия, касающиеся коллигативных свойств растворов.
Коллигативные свойства растворов.
Коллигативными называются такие свойства растворов, которые зависят только от концентрации, но не от природы растворенных веществ. К ним относятся изменение температуры кипения и замерзания, а также осмотическое давление.
A. Повышение температуры кипения
Если парообразование происходит не только со свободной поверхности жидкости, но и внутри ее, то этот процесс называют кипением. Чистый растворитель или раствор начинает кипеть при такой температуре, при которой давление пара растворителя над чистым растворителем или раствором равно внешнему давлению.
Как видно из рис. 25.1, температура кипения идеального раствора тем выше температуры кипения чистого растворителя, чем больше его концентрация: при то=0<т1<т2, 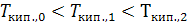 и следовательно,
и следовательно,
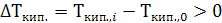
Рис. 25.1. Зависимость давления насыщенного пара растворителя над чистым растворителем (m0) и над растворами (m1 и m2) от температуры.
Для растворов неэлектролитов это повышение температуры кипения пропорционально моляльной концентрации раствора т (моль/1 кг растворителя):
ΔTкип. = Em, (25.1)
где Е- эбулиоскопическая постоянная растворителя, не зависящая от природы растворенного вещества. Для воды 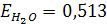 , для бензола
, для бензола 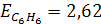 .
.
Для растворов электролитов это уравнение принимает вид
ΔТкип=Еim, (25.2)
где i – изотонический коэффициент Вант-Гоффа, показывающий, во сколько раз возросло (уменьшилось) число частиц растворенного вещества вследствие диссоциации (ассоциации) его частиц.
Для растворов сильных электролитов теоретически изотонический коэффициент должен быть равен числу частиц, на которые распадается молекула при диссоциации (i = ν). Однако получаемая в результате эксперимента величина обычно меньше ν. Причиной этого является электростатическое взаимодействие между ионами в растворе сильного электролита. Степень такого взаимодействия характеризуется осмотическим коэффициентом g = i/v<1. Для бесконечно разбавленных растворов i=v и g=1.
Исходя из уравнения (25.2), можно после ряда преобразований выразить эбулиоскопическую постоянную через удельную теплоту испарения чистого растворителя Δhисп.,0 и его температуру кипения Tкип.,0:
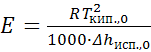 . (25.3)
. (25.3)
Дата добавления: 2017-09-01; просмотров: 1344;










