Обжиг сидеритовых руд
Сидеритовые руды подвергают обжигу перед их металлургической плавкой с целью удаления из них углекислого газа и магнитного обогащения обожженного продукта. Например, так обогащают сидеритовые руды на обжиг на обогатительной фабрике Бакальского рудоуправления. Руду класса 60 - 10 мм обжигают в шахтных печах (рисунок 14) суммарной мощностью 750 тыс. т руды в год при температуре 1070 - 1170 К в течение 7 - 8 ч, в том числе 2 ч руда находится в зоне обжига. Обожженную руду рассеивают на классы 60 - 8 и 8 - 0 мм. Класс 60 - 8 мм подвергают сухой магнитной сепарации, а 8 - 0 мм направляют на агломерацию. Концентрат магнитной сепарации содержит 49 - 50% железа при извлечении его около 75%. Расход природного газа на обжиг - 46 - 49 м3/т руды. Природные сидериты представляют собой комплексное сырье, содержащее не только карбонаты Fе, но и Сa, Мg, Мn. Поэтому процесс его разложения целесообразно рассмотреть подробнее.
Для обжига на воздухе, сопровождающегося выделением. СO2, важно установить температуру, при которой его давление составит 30 Па, так как ниже этой температуры разложение невозможно, а выше - начинается химическое испарение. Когда 30 Па < 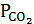 < 1·105 Па, СO2 диффундирует в порах карбоната и происходит химическое испарение. При давлении СO2 больше 1·105 Па начинается химическое кипение, эта температура соответствует температуре начала разложения карбоната.
< 1·105 Па, СO2 диффундирует в порах карбоната и происходит химическое испарение. При давлении СO2 больше 1·105 Па начинается химическое кипение, эта температура соответствует температуре начала разложения карбоната.
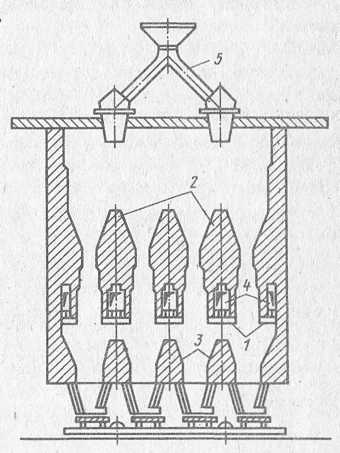
1 - опорные балки; 2 - разделительные стенки; 3 - направляющие для
разгрузки; 4 - газоходы; 5 - загрузка руды
Рисунок 14. Шахтная печь для обжига сидеритов
Кривая упругости диссоциации позволяет установить температуру начала разложения при различных давлениях. Упругость диссоциации (константа равновесия) химической реакции, определяют методом расчета равновесия по стандартным данным (второе приближение), и записывают в виде lgKp = lg 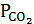 = - ΔH298 : 2,3·R·T + ΔS298 : 2,3·R + ΔCp; [ln(T : 298) - 1 + 298 : T)] : 2,3 ·R,где ΔH298, ΔS298, ΔCp - алгебраическая сумма энтальпий, энтропий, теплоемкостей реагентов в стандартном состоянии.
= - ΔH298 : 2,3·R·T + ΔS298 : 2,3·R + ΔCp; [ln(T : 298) - 1 + 298 : T)] : 2,3 ·R,где ΔH298, ΔS298, ΔCp - алгебраическая сумма энтальпий, энтропий, теплоемкостей реагентов в стандартном состоянии.
Бакальские сидеритовые руды в своем составе э качестве основного рудного минерала содержат сидероплезит (Fе0,72, Mg0,25, Mn0,03) СO3 затраты тепла на диссоциацию этого карбоната и тепловой эффект реакции окисления приведены в работе. Для термодинамического анализа необходимо также знать значения энтропий и теплоемкостей в стандартных условиях для этой разновидности сидероплезита. Применительно к сидероплезитам термодинамический анализ их разложения выполнен Н.В. Ахлюстиной. Вычисление термодинамических характеристик процесса диссоциации, изучаемых сидероплезитом, выполнялось исходя из того, что атомы Fе, Мg, Мn, Сa образуют единую решетку минерала и при разложении она разрушается вся с постепенным выделением газообразных продуктов. Это подтверждается дериватограммой твердого раствора карбонатов, где на кривой ДТА наблюдается не три пика, а один, что свидетельствует о единстве решетки минерала, а разложение всего минерала с образованием оксидов происходит как единый химический акт, а не ступенчато. Рассчитывают теплоту образования соединений в предположении, что общая решетка минерала образовалась без дополнительных затрат тепла.
Разложение карбонатов, входящих в состав сидероплезита, описывается уравнениями: FеСO3 = FеO + СO2; МgСO3 = МgO + СO2; МnСО3 = МnО + СO2; СаСO3 = СаО + СO2. Одновременно с реакцией разложения происходит окисление: FеО + 1/3СO2 = 1/3Fе3O4 + 1/3СО; МnО + 1/3СO2 = 1/3Мn3О4 + 1/3СО, т.е. газообразными продуктами являются и СO2 и СО. Значения теплоемкостей, энтропий и теплоты образования соединений взяты по работе, кроме теплоты образования FеСО3 и МnСO3. Затраты тепла на диссоциацию сидерита, с учетом процентного содержания каждого карбоната: 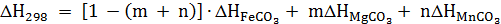 , где m, n - коэффициенты в формуле сидероплезита:
, где m, n - коэффициенты в формуле сидероплезита: 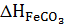 ,
, 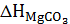 ,
, 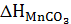 - теплоты образования карбонатов Fе, Мg и Мn, Дж/(моль·К). Аналогично вычисляют значения теплоемкости, энтальпии, энтропии температуры начала разложения (ТНР) и теплоты образования (Q) (таблица 9).
- теплоты образования карбонатов Fе, Мg и Мn, Дж/(моль·К). Аналогично вычисляют значения теплоемкости, энтальпии, энтропии температуры начала разложения (ТНР) и теплоты образования (Q) (таблица 9).
Для упрощения принято допущение: в формуле сидеритоплезита учте ны только катионы Fe, Mg и Са, а катионы Мn не учтены, так как коэф фициенты при нем невелики (0,02—0,03).
С учетом теплоты образования приведены значения упругости диссоциации (lg рСО2 + СО) сидеритов и сидероплезитов при температуре, К (таблица 10).
При температурах 550—600 К упругость диссоциации сидероплезитов и сидеритов превышает давление СО2 в воздухе (РCO2 = 30 Па). При этих температурах начинается медленное "химическое испарение" данных образцов, которое лимитируется диффузией выделяющихся газов в воздухе. При температурах 723—773 К для бакальских сидероплезитов и 683-773 К для сидероплезитов и сидеритов других месторождений упругость диссоциации превышает 1 * 105 Па и становится возможным быстрое "химическое кое кипение" карбонатов, которое не тормозится диффузией.
Таблица 9-термодинамические характеристики сидеритотвых руд
| Название | ∆Н298, Дж/моль | AS298, Дж/(моль * К) | ∆С 298, Дж/ (моль *К) | Q | ТНР,К | ТНР (эксп.), К |
| Бакальское: | ||||||
| 179,28 | 2,51 | |||||
| 179,11 | 2,26 | |||||
| 178,06 | 1,42 | |||||
| Геленджикское* | 177,98 | 1,80 | ||||
| Ахтенское | 179,53 | 2,55 | ||||
| Киргишанское* | 179,00 | 2,51 |
* Содержат также Са.
Таблица 10-Упругость диссоциации сидеритов и сидероплезитов
| Температуры, К | |||||
| Бакальское: | |||||
| -4,496 | -2,285 | 0,480 | 2,149 | 3,588 | |
| -4,789 | -2,523 | 0,317 | 2,028 | 3,502 | |
| -4,893 | -2,580 | 0,318 | .2,061 | 3,561 | |
| Ахтенское | -4,488 | -2,285 | 0,479 | 2,145 | 3,581 |
| Геленджикское | -4,570 | -2,355 | 0,423 | 2,096 | 3,539 |
| Киргишанское | -3,405 | -1,399 | 1,118 | 2,636 | 3,947 |
Дата добавления: 2017-06-13; просмотров: 2571;










