Значение столкновений между молекулами
Столкновения между молекулами существенны, так как именно благодаря этим столкновениям газ переходит в состояние теплового равновесия. В этом состоянии молекулы в сосуде движутся в полном беспорядке, так что во всех частях сосуда наблюдается полный хаос. Столкновения между молекулами в состоянии равновесия газа уже ничего принципиально не меняют. Они не влияют ни на давление, ни на температуру газа. Поэтому в состоянии теплового равновесия можно вообще пренебречь размерами молекул и считать, что молекулы идеального газа — это материальные точки.
Конечно, с помощью такой простой модели нельзя объяснить все без исключения процессы в разреженных газах (например, оптические явления). Но мы поставим и будем решать частную задачу: вычислить с помощью молекулярно-кинетической теории давление газа. Для этой задачи простейшая модель газа оказывается вполне удовлетворительной. Она приводит к результатам, которые подтверждаются опытом. Идеальный газ — модель реального газа. Молекулы этого газа — крошечные шарики, не взаимодействующие друг с другом; точнее, кинетическая энергия молекул много больше потенциальной энергии их взаимодействия.
ОСНОВНОЕ УРАВНЕНИЕ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОИ ТЕОРИИ
Пусть газ находится в прямоугольном сосуде с твердыми стенками. Газ и сосуд имеют одинаковые температуры, т. е. находятся в состоянии теплового равновесия. Будем считать столкновения молекул со стенками абсолютно упругими. При этом условии кинетическая энергия молекул в результате столкновения не меняется.
Требование того, чтобы столкновения были абсолютно упругими, не является строго обязательным. В точности оно и не реализуется. Молекулы могут отражаться от стенки под разными углами и со скоростями, не равными по модулю скоростям до соударения. Но в среднем кинетическая энергия отраженных стенкой молекул будет равна кинетической энергии падающих молекул, если только существует тепловое равновесие. Результаты расчета не зависят от детальной картины столкновений молекул со стенкой. Поэтому вполне допустимо считать столкновения молекул подобными столкновениям упругих шаров с абсолютно гладкой твердой стенкой.
Давление газа
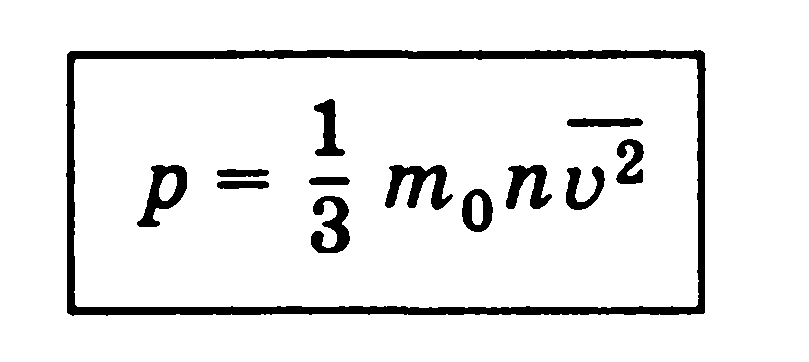
Это основное уравнение молекулярно-кинетической теории идеального газа.
Давление идеального газа пропорционально произведению массы молекулы на концентрацию молекул и средний квадрат их скорости.
Эта формула связывает макроскопическую величину — давление, которое может быть измерено манометром, — с микроскопическими величинами, характеризующими молекулы, и является как бы мостом между двумя мирами: макроскопическим и микроскопическим.
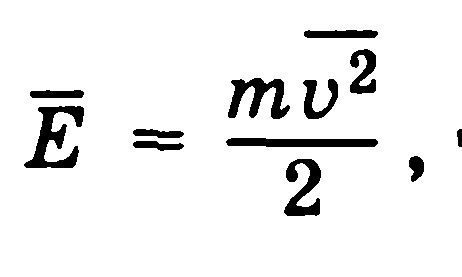 Если через Е обозначить среднюю кинетическую энергию поступательного движения молекулы:
Если через Е обозначить среднюю кинетическую энергию поступательного движения молекулы:
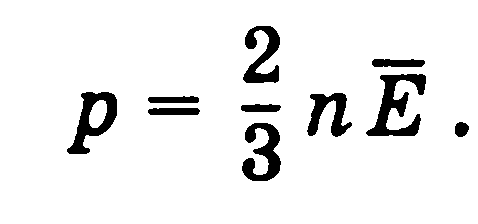 то уравнение можно записать в форме:
то уравнение можно записать в форме:
Дата добавления: 2017-05-02; просмотров: 987;










