Условия равновесия двухфазной однокомпонентной системы
Фазой называется макроскопическая, физически однородная часть системы, отличающаяся по физическим свойствам от других частей и отделенная от них четко выраженной границей.
Примерами двухфазных систем могут служить жидкость и ее насыщенный пар, кристалл и его расплав и т.д. Такие системы мы уже встречали ранее (см. § 12).
Рассмотрим однокомпонентную (т.е. состоящую из химически однородного вещества) систему, разделенную на две фазы a и b. Обозначим na - число молей вещества в фазе a, а nb - в фазе b. Полное количество вещества n в системе остается постоянным (n = na + nb = const).
Будем считать, что в системе установилось тепловое и механическое равновесие, т.е. температуры и давления в каждой из фаз одинаковы. Так как химический потенциал является функцией температуры и давления (m = m(Т,Р)), то химические потенциалы фаз тоже остаются неизменными.
Единственным процессом, возможным в системе при постоянстве Т и Р, является фазовый переход, т.е. переход вещества из одной фазы в другую. Для определения направления переноса вещества можно воспользоваться тем, что, как показано в предыдущем параграфе, термодинамический потенциал такой системы может только убывать ( 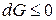 ). Представим термодинамический потенциал в виде
). Представим термодинамический потенциал в виде
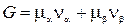 .
.
Тогда 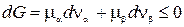 .
.
Так как na + nb = const, то dna = -dnb, и предыдущее соотношение можно переписать так
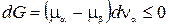 . (22.1)
. (22.1)
Отсюда следует, что при ma > mb dna < 0, т.е. G уменьшается при переходе вещества из фазы a в фазу b. При mb > ma dna > 0. Поток вещества направлен от фазы с большим химическим потенциалом к фазе с меньшим химическим потенциалом. По отношению к переходу вещества из одной фазы в другую химический потенциал играет такую же роль, какую температура играет для потока тепла или давление для потока газа в соответствующих процессах выравнивания. Уменьшение термодинамического потенциала прекратится, когда в системе останется только одна фаза.
Таким образом, если 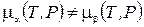 , двухфазная система спустя некоторое время превратится в однофазную. Равновесие двух фаз возможно только при
, двухфазная система спустя некоторое время превратится в однофазную. Равновесие двух фаз возможно только при
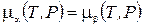 . (22.2)
. (22.2)
Это уравнение связывает значения температуры и давления, при которых две фазы могут сосуществовать. В принципе уравнение (22.2) позволяет выразить один из аргументов химического потенциала через другой, например Р = Р(Т), но для этого надо иметь аналитические выражения для химических потенциалов, которые далеко не всегда доступны. Однако можно и не зная конкретного вида формул m(Т,Р), найти зависимость Р от Т в дифференциальном виде. Для этого запишем дифференциалы химических потенциалов фаз
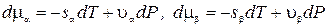 .
.
Из (22.2) следует, что 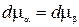 , а значит
, а значит 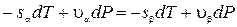 или
или
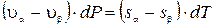 ,
,
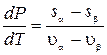 .
.
В этом выражении разность молярных энтропий sa -sbможно связать с теплотой lb-a, которую необходимо сообщить системе для перехода одного моля вещества из фазы b в фазу a.
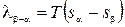 .
.
Тогда
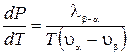 . (22.3)
. (22.3)
Это соотношение называется уравнением Клапейрона-Клаузиуса. Оно уже было получено ранее методом циклов (см. § 12).
Дата добавления: 2017-03-12; просмотров: 2666;










