ЭДС электрохимической системы. Электродный потенциал
Электрохимическая цепь – представляет собой систему, состоящую из различных фаз, через границу раздела которых проходят заряженные частицы, что вызвано стремлением системы к термодинамическому равновесию. При этом на границе раздела фаз возникают скачки потенциалов. ЭДС электрохимической цепи равно сумме скачков потенциалов на границе раздела фаз. Электрохимические цепи состоят из нескольких последовательно соединенных электродов, концевыми фазами являются металлы. ЭДС элемента или цепи может быть измерена как разность потенциалов фаз, находящихся на концах цепи.
Для электрохимической цепи рассматриваются три основных типа скачков потенциалов:
1) Скачок потенциала на границе металл - металл – контактный скачок потенциала;
2) Скачок потенциала на границе металл - раствор – электродный скачок потенциала;
3) Диффузионный скачок потенциала на границе раствор - раствор.
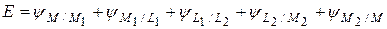 (2.51)
(2.51)
Где L1 и L2 – два раствора электролита, в которые опущены электроды, изготовленные из металлов М1 и М2.
При переходе через границу раздела фаз раствор - металл заряженных частиц (ионы, электроны) происходит электрохимическая реакция, на границе их раздела возникает двойной электрический слой, которому соответствует скачек потенциала.
Электродные процессы представляют собой окислительно-восстановительные реакции вида:
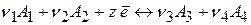
Если в электродном процессе участвует одно вещество, то запись проще:
Ох + z 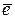 ⇆ Red
⇆ Red
окисленная восстановленная
форма форма
Электродные потенциалы на границе раствор - металл экспериментально определить невозможно. Поэтому электродный потенциал принято считать равным ЭДС цепи, составленной из водородного (слева) и данного электрода (справа).
Водородный электрод взят в стандартном состоянии ( 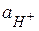 =1), парциальное давление газа равно нормальному атмосферному р = 1,013∙105 Па. Его потенциал при любой температуре условно принят равным нулю.
=1), парциальное давление газа равно нормальному атмосферному р = 1,013∙105 Па. Его потенциал при любой температуре условно принят равным нулю.
Причинами возникновения потенциала на границе металл - раствор являются:
1. ионизация атомов металла на ионы и электроны внутри металла;
2. сольватация ионов металла, находящихся на его поверхности, при соприкосновении с раствором L.
Дата добавления: 2017-03-12; просмотров: 3877;










