Влияние химических взаимодействий
В растворе могут протекать одна или несколько побочных реакций с ионами осадка (образование малодиссоциированного соединения, комплекса и т.д.).
Например, равновесие в насыщенном растворе оксалата кальция в присутствии соляной кислоты HCl можно представить так:
CaC2O4тв ó Ca2+ + C2O42–
HCl ó H+ + Cl–
Побочные (конкурентные) реакции C2O42– + H+ ó HC2O4–
HC2O4– + H+ ó H2C2O4
В этом случае для описания равновесия между раствором и осадком используют условное произведение растворимости ПРу,которое выражается даже не через равновесные, а через общие или аналитические концентрации С.
ПРу = САа·СВв
Или применительно к нашему случаю
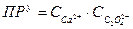
ПРу = f(T, P, природы растворителя, ионной силы μ, мольных долей соответствующих ионов αА и αВ)
Связь с термодинамическим произведением растворимости:
ПРт = аАа ·аВв = [A]a·[B]b·fAa·fBb = САа·СВв fAa·fBb αА·αВ = ПРу·fAa·fBb αАа·αВв
Поскольку влияние электростатических взаимодействий сказывается на растворимости значительно слабее, чем химические взаимодействия, то при расчете условного ПР сомножитель, состоящий из коэффициентов активности fAa·fBb, не учитывают.
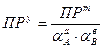
Итак, когда и каким ПР следует пользоваться?
1. В реальной практике, если электролит мало растворим ПР < 10-7 и ионная сила раствора μ стремится к 0, пользуются ПРт.
2. μ≠0 (заметно растворимое соединение или присутствует посторонний сильный электролит). Пользуются ПРр.
3. Если нельзя пренебречь конкурентными реакциями, равновесие раствор-осадок описывают с помощью ПРу.
Под растворимостью S понимают способность веществ образовывать гомогенную систему с растворителем. Растворимость измеряют в моль/л, г/100мл, г/мл и т.д. Растворимость осадков – важная величина, позволяющая определять концентрацию вещества в насыщенном растворе, рассчитать возможность образования осадка и т.д.
Если осадок малорастворимого сильного электролита АВ состоит из ионов одинаковой зарядности, тогда растворимость S – это равновесная концентрация иона А или иона В. Если обозначить эту концентрацию через x, то
ПР = [A]·[B] = x2
S = x = 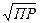
Для осадка электролита, состоящего из ионов разной зарядности АаВв равновесие в насыщенном растворе
АаВтв ó aA + вВ
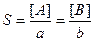
Отсюда [A] = a·S и [B] = b·S
ПР (АаВв)= [A]a·[B]b = [a·S]a·[ b·S]b = aa·bb·Sa+b . Отсюда
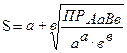
Например, растворимость хромата серебра Ag2CrO4 (ПР = 1,44·10-12) можно рассчитать
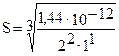 = 7,5·10-5моль/л.
= 7,5·10-5моль/л.
Чем меньше растворимость, тем труднее растворяется электролит. Например, BaSO4 (ПР = 1,05·10-10) с трудом при кипячении растворяется только в концентрированной серной кислоте, в то время как CaSO4 (ПР = 9,1·10-6) довольно хорошо растворим в воде – гипсовая вода.
Дата добавления: 2017-03-12; просмотров: 1223;










