Влияние электростатических взаимодействий
В присутствии посторонних ионов, создающих вокруг ионов осадка ионную атмосферу, но не вступающих с ними в химические реакции, а также при достаточно большой концентрации собственных ионов (при ПРт> 1·10-7) растворимость осадка меняется. В этом случае равновесие раствор – осадок описывается ПРр.
μ ≠ 0; f ≠ 1;
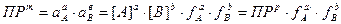
Реальное произведение растворимости зависит от температуры, давления, природа растворителя и ионной силы раствора.
ПРр = f(T, P, природы растворителя, μ)
Т.е. произведение равновесных концентраций малорастворимого электролита в растворе над осадком в степенях соответствующих коэффициентов есть величина постоянная при постоянной температуре, давлении и ионной силе раствора.
Как изменяется растворимость в присутствии посторонних сильных электролитов, создающих в растворе ионную силу? Рассмотрим для примера насыщенный раствор сульфата свинца PbSO4 и добавим к нему раствор нитрата калия KNO3. Этот электролит не имеет общих ионов с осадком. Но он увеличивает ионную силу раствора над осадком.
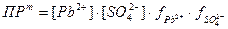
Растворимость S сульфата свинца определяется равновесными концентрациями ионов свинца и сульфат-ионов, которые равны:
S = [Pb2+] = [SO42-] = 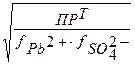
С ростом ионной силы раствора μ величины коэффициентов активности f(Pb2+) и f(SO42-) уменьшаются, а значение ПРт остается постоянным. Значит, с ростом ионной силы растворимость сульфата свинца увеличивается.
Увеличение растворимости осадка малорастворимого сильного электролита в присутствии постороннего сильного электролита называется солевым эффектом.
Физическая причина повышения растворимости ясна: стесненные в своих движениях межионными силами ионы Pb2+ и·SO42- реже сталкиваются с поверхностью кристаллов PbSO4. В результате нарушается равновесие – процесс перехода Pb2+ и·SO42- в раствор оказывается более интенсивным, чем процесс их осаждения. Затем равновесие устанавливается при новой, большей концентрации ионов в растворе.
Дата добавления: 2017-03-12; просмотров: 1492;










