Уравнения и линии равновесия
Обычно при расчетах массообменных процессов фактические или рабочие концентрации распределяемого между фазами вещества заданы. Чтобы определить направление процесса и его скорость, необходимо знать равновесные концентрации при рабочих условиях или зависимость равновесных концентраций у* распределяемого вещества в одной фазе от рабочей концентрации х в другой:
y* =f(x)
Например,
y* = mxn
где m и n - величины, определяемые опытным путем.
Значение m зависит от физико-химических свойств системы, от температуры, давления, а часто и от концентрации распределяемого между фазами вещества. Поэтому на диаграмме в координатах у-х линии равновесия, описываемые этими зависимостями, могут иметь вид кривых.
Для идеальных систем (например, растворов) уравнения линии равновесия известны. Например, для идеального раствора, если его температура выше критической температуры растворяющегося газа, применяется закон Генри, по которому парциальное давление растворенного газа пропорционально его молярной доле в растворе:
p* = Ex
где p* - парциальное давление поглощаемого газа над раствором, находящегося в равновесии, при концентрации раствора х; E - константа Генри.
Из закона Дальтона:
р = Ру
Тогда:
y* = Ex/P = mx
где Р - обшее давление в системе.
Значение m в уравнении зависит от общего давления и от температуры. С ростом температуры m увеличивается, при этом растворимость газа снижается; с увеличением общего давления значение m снижается, что приводит к увеличению растворимости газа.
При постоянных температуре и давлении зависимость между равновесными значениями у и рабочими х выражается графически прямой линией, проходящей через начало координат, с углом наклона, тангенс которого равен m.
Закон Генри точен для идеальных растворов. Для реальных растворов он применим с достаточной точностью только при сильном разбавлении.
Если температура идеального раствора ниже критической температуры газа, т.е. происходит конденсация газа, то система подчиняется закону Рауля:
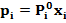
Из этого выражения следует, что парциальное давление пара i-гo компонента над раствором равно произведению давления пара чистого компонента (т.е. давления насыщенного пара этого компонента) при температуре раствора на его мольную долю в жидкой фазе.
Для двухкомпонентной смеси состава А-В законы Рауля и Дальтона дают связь между рабочими и равновесными концентрациями:
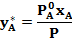
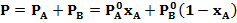
Откуда
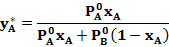
Поделив последнее выражение на 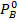 и обозначив
и обозначив 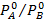 через a (где a - относительная летучесть компонентов), получим:
через a (где a - относительная летучесть компонентов), получим:
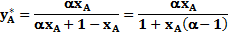
Это уравнение является уравнением кривой линии. Отметим, что коэффициенты относительной летучести мало изменяются с изменением температуры и снижаются при увеличении давления в системе, что приводит к ухудшению условий разделения смеси.
Если для данной системы закон равновесного распределения вещества между фазами неприменим, то эту зависимость можно найти по справочникам и построить соответствующую кривую на фазовой диаграмме. Чаше приходится пользоваться экспериментальными данными, т.к. законы распределения получены для идеальных систем.
Знай равновесные и рабочие концентрации, можно найти направление процесса: из какой фазы и в какую будет переходить распределяемое между фазами вещество. Таким образом, распределяемое между фазами вещество в точке контакта фаз переходит в ту фазу, рабочая концентрация которой меньше равновесной.
Кроме того, знание разности равновесных и рабочих концентраций позволяет определить движущую силу переноса массы, что необходимо для расчета скорости процесса массопереноса.
Дата добавления: 2017-03-12; просмотров: 4464;










