Простейшие типы диаграмм состояния сплавов
Диаграмма – это графическое изображение состояния сплавов в зависимости от состава и температуры. Диаграммы строятся для условий равновесия, которые создаются при очень медленном охлаждении или нагревании сплавов, когда ни один процесс не затормаживается, все превращения идут до конца.
Диаграммы строятся экспериментально по критическим точкам. Критические точки – это температуры, при которых в сплаве происходит какое-то превращение (например, затвердевание – расплавление, аллотропическое превращение, распад твердого раствора и т.д.). Критические точки находят термическим или каким-либо другим методом. При термическом анализе для каждого сплава данной системы строят кривую охлаждения. Все превращения сопровождаются тепловым эффектом (выделение или поглощение тепла) что приводит или к температурным остановкам, или перегибам кривой охлаждения сплава из жидкого состояния (см. рис. 5.4): 1 и 2 – критические точки.
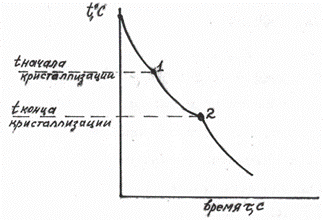
Рис. 5.4 Кривая охлаждения сплава, где компоненты дают твердый раствор  (20% В, 80% А – см. рис. 5.5)
(20% В, 80% А – см. рис. 5.5)
Полученные критические точки наносятся в координатах состав-температура. Соединяя однотипные точки, получаем диаграмму состояния (см. рис. 5.5).
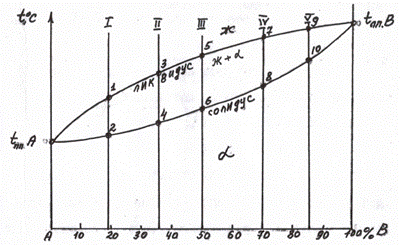
Рис. 5.5 Линии диаграммы, построенные по критическим точкам (ликвидус и солидус)
Например, в сплавах 1, 2, 3, 4, 5 были найдены критические точки (рис. 5.5). Соединяя точки начала кристаллизации (1, 3, 5, 7, 9), получаем линию ликвидус. Соединяя точки конца кристаллизации, получаем линию солидус. Таким образом, зная температуры плавления чистых компонентов А и В, получаем диаграмму для случая неограниченной растворимости.
Рассмотрим 4 типа простейших диаграмм.
Диаграмма 1 типа (случай образования механической смеси с эвтектикой, рис. 5.6).
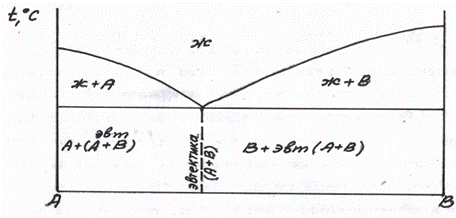
Рис. 5.6,а Диаграмма состояния 1 типа
Для того, чтобы понимать диаграммы состояния сплавов, необходимо уметь пользоваться правилом отрезков.
Правило отрезков
Оно действует только в двухфазных областях. С его помощью можно установить:
- какие фазы находятся в данной двухфазной области;
- химический состав каждой фазы;
- количественное соотношение фаз.
Для определения первых двух вопросов необходимо в двухфазной области при заданной температуре провести коноду (рис. 5.6,б, сплав 1).
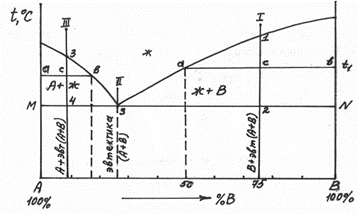
Рис. 5.6,б Диаграмма состояния 1 типа с демонстрацией правила отрезков.
Концы коноды а и б указывают, что в данной двухфазной области находятся: жидкость состава «а» и кристаллы компонента В (100%В). Количественное соотношение жидкой и твердой фазы при температуре 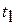 можно определить, пользуясь также правилом отрезков. Для этого составляем пропорцию: конода аб соответствует количеству всего сплава – 100%; количеству твердой фазы (кристаллов В) соответствует отрезок, прилежащий к противоположной фазе, т.е. отрезок ас:
можно определить, пользуясь также правилом отрезков. Для этого составляем пропорцию: конода аб соответствует количеству всего сплава – 100%; количеству твердой фазы (кристаллов В) соответствует отрезок, прилежащий к противоположной фазе, т.е. отрезок ас:
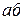 – 100%
– 100%
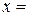
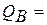
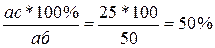
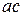 -
- 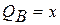
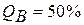
Значит, 50% сплава затвердело.
Разберем, пользуясь правилом отрезков, диаграмму 1 типа. Сначала рассмотрим кристаллизацию сплава 2 (рис. 5.6,б). В критической точке S из жидкого расплава начинают выделяться сразу два типа кристаллов – А и В (концы коноды М и N упираются в эти фазы). Механическая смесь двух видов кристаллов, образующаяся при постоянной температуре, является эвтектикой. Таким образом, в т.S вся жидкость превращается в эвтектику (при постоянной температуре). Кривая охлаждения этого сплава представлена на рис. 5.7.
Разберем кристаллизацию сплава 1 (заэвтектического) – рис. 5.6,б. В критической точке 1 из жидкого расплава начинают выделяться кристаллы компонента В. При охлаждении от т.1 до т.2 состав жидкой фазы изменяется по кривой 1S. При подходе к критической точке 2 количество не затвердевшего
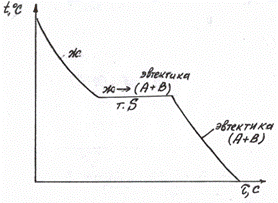
Рис. 5.7 Кривая кристаллизации сплава 2 (на рис. 6,б)
(эвтектического)
сплава (жидкости) соответствует отрезку 2N, а количеству твердой фазы (кристаллов В) соответствует отрезок S2. Состав жидкой фазы соответствует т.S – эвтектической. Таким образом, в т.2 происходит затвердевание жидкости эвтектического состава с образованием эвтектики (А+В). Ниже т.2 сплав состоит из В+ эвт (А+В) . Таким же образом разберем кристаллизацию сплава 3 (доэвтектического), рис. 5.8. Конец коноды «д» показывает, что в т.3 из жидкости начинают выделяться кристаллы компонента А. Состав жидкой фазы при охлаждении от т.3 до т.4 изменяется по кривой 3S. В т.3 оставшаяся жидкость, приняв эвтектический состав, превратится в эвтектику (А+В). Кривая кристаллизации сплава 3 представлена на рис. 5.8.
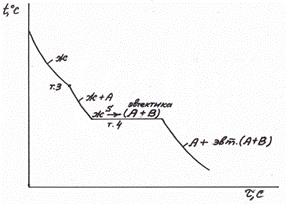
Рис. 5.8 Кривая охлаждения сплава 3
(доэвтектического)
Диаграмма состояния 2 типа (случай неограниченной растворимости компонентов в друг друге – рис. 5.9).
Неограниченная растворимость будет иметь место при следующих условиях:
1)Компоненты имеют один тип кристаллической решетки (изоморфны) с небольшим различием в параметрах.
2)Компоненты находятся близко в таблице Менделеева и имеют близкие атомные размеры.
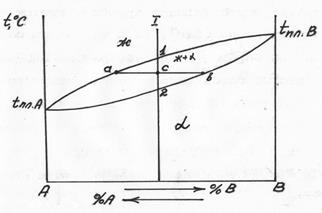
Рис. 5.9 Диаграмма состояния 2 типа
В этом случае атомы как бы взаимозаменяемы в кристаллической решетке. Заменяя атомы одного компонента на атомы другого компонента в кристаллической решетке получают непрерывный ряд твердых растворов. Когда будут заменены все атомы, получается чистый второй компонент. Твердые растворы, как уже упоминалось, обозначают 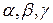 и т.д., рис. 5.9. Выше линии ликвидус – жидкость, ниже линии солидус – твердый раствор
и т.д., рис. 5.9. Выше линии ликвидус – жидкость, ниже линии солидус – твердый раствор  . Между линией ликвидус и солидус – двухфазная область, состоящая из ж+
. Между линией ликвидус и солидус – двухфазная область, состоящая из ж+  (см. концы коноды аб). Количество жидкой фазы в сплаве 1 при температуре т.С соответствует отрезку «сб». При снижении температуры до т.2 отрезок «сб» обращается в ноль, следовательно. При подходе к линии солидус затвердевают остатки жидкости. Кривая кристаллизации твердого раствора не имеет ступеньки (рис. 5.10).
(см. концы коноды аб). Количество жидкой фазы в сплаве 1 при температуре т.С соответствует отрезку «сб». При снижении температуры до т.2 отрезок «сб» обращается в ноль, следовательно. При подходе к линии солидус затвердевают остатки жидкости. Кривая кристаллизации твердого раствора не имеет ступеньки (рис. 5.10).
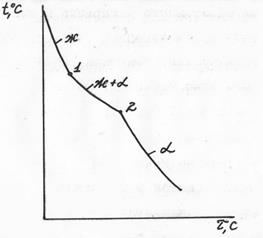
Рис. 5.10 Кривая охлаждения сплава 1 на диаграмме 2 типа.
Диаграмма состояния 3 типа(случай ограниченной растворимости компонентов).
Случаи неограниченной растворимости очень редки, чаще встречается ограниченная растворимость, будет участок диаграммы 2 типа.
Существует несколько вариантов диаграмм 3 типа.
1 вариант (рис. 5.11).
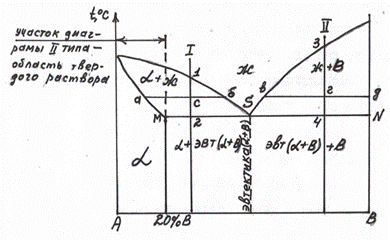
Рис. 5.11 Диаграмма 3 типа (1 вариант)
На том участке, где имеет место диаграмма 2 типа (указан на рис. 5.11), будет происходить кристаллизация твердого раствора  . В т. S в сплаве кристаллизуется эвтектика, которая состоит из кристаллов
. В т. S в сплаве кристаллизуется эвтектика, которая состоит из кристаллов  и
и 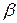 (на эти фазы указывают концы коноды М и N). При кристаллизации сплава 1 в т.1 (рис. 5.11) из жидкости начинают выделяться кристаллы твердого раствора
(на эти фазы указывают концы коноды М и N). При кристаллизации сплава 1 в т.1 (рис. 5.11) из жидкости начинают выделяться кристаллы твердого раствора  . При охлаждении до т.2 состав жидкой фазы изменяется по кривой 1S, в т.2 оставшаяся жидкость состава т.S превращается в эвтектику (
. При охлаждении до т.2 состав жидкой фазы изменяется по кривой 1S, в т.2 оставшаяся жидкость состава т.S превращается в эвтектику ( 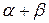 ) – см. рис. 5.11.
) – см. рис. 5.11.
Кристаллизация сплава 2 начинается в т.3 с выделением кристаллов В (рис. 5.11). Оставшаяся жидкость в т.4, приняв состав т.S, превращается в эвтектику ( 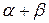 ).
).
2 вариант диаграммы 3 типа
На предыдущей диаграмме 3 типа растворимость составляет 20% В и не изменяется с повышением температуры. На диаграмме (рис. 5.12) растворимость повышается с возрастанием температуры от 10% до 30% В.
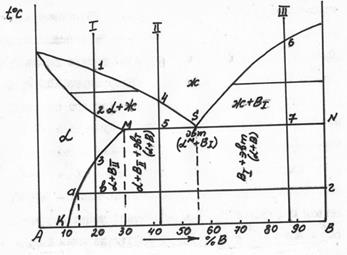
Рис. 5.12 Диаграмма 3 типа с изменяющейся растворимостью
Разберем кристаллизацию сплава, содержащего 20% В (рис. 5.12). Выше линии ликвидус на диаграмме находится область расплава – жидкость. На участке диаграммы, где линии ликвдус и солидус образуют часть диаграммы 2 типа, кристаллизуется твердый раствор А(В) -  . Между точками 1 и 2, исходя из правила отрезков, находится
. Между точками 1 и 2, исходя из правила отрезков, находится  +ж. В т.2 жидкость закристаллизовывается в
+ж. В т.2 жидкость закристаллизовывается в  , который содержит 20% В. Ниже т.3
, который содержит 20% В. Ниже т.3  -раствор не может растворить 20% В, например, в т. «в»
-раствор не может растворить 20% В, например, в т. «в»  -раствор может растворить 15% В. Значит, ниже т.3 из
-раствор может растворить 15% В. Значит, ниже т.3 из  -раствора должна выделяться фаза, богатая компонентом В. Эту фазу определяем, пользуясь правилом отрезков – конец коноды 2г» показывает, что в т. «в» существуют зерна Вп. Кристаллиты В называют вторичными, т.к. они выделяются из
-раствора должна выделяться фаза, богатая компонентом В. Эту фазу определяем, пользуясь правилом отрезков – конец коноды 2г» показывает, что в т. «в» существуют зерна Вп. Кристаллиты В называют вторичными, т.к. они выделяются из  -раствора; в отличие от Вп кристаллы В1 выделяются из жидкой фазы.
-раствора; в отличие от Вп кристаллы В1 выделяются из жидкой фазы.
Рассмотрим кристаллизацию эвтектического сплава (62% В). В т.S жидкость кристаллизуется при постоянной температуре с получением эвтектики ( 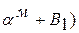 см. коноду MN (рис. 5.12). Ниже т.S состав кристаллов
см. коноду MN (рис. 5.12). Ниже т.S состав кристаллов  изменяется, т.к. растворимость падает, и из
изменяется, т.к. растворимость падает, и из  выделяются кристаллики Вп (обычно в виде сетки по границам зерен
выделяются кристаллики Вп (обычно в виде сетки по границам зерен  ). Таким образом, при комнатой температуре сплав будет состоять из
). Таким образом, при комнатой температуре сплав будет состоять из 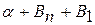 , т.е. из
, т.е. из 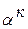 , содержащего 10% В, и кристаллов В.
, содержащего 10% В, и кристаллов В.
При кристаллизации доэвтектического сплава П в т.4 из жидкости начинают выделяться кристаллы  -раствора. В т.5 оставшаяся жидкость кристаллизуется с образованием эвтектики. В результате, после затвердевания в т.5 сплав состоит из
-раствора. В т.5 оставшаяся жидкость кристаллизуется с образованием эвтектики. В результате, после затвердевания в т.5 сплав состоит из 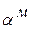 +эвт (
+эвт ( 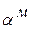 +В1). С понижением температуры из
+В1). С понижением температуры из  (состава точки М – 30% В) начинают выделяться кристаллы Вп. При комнатной температуре сплав состоит из
(состава точки М – 30% В) начинают выделяться кристаллы Вп. При комнатной температуре сплав состоит из 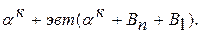 Кристаллизация сплава 3: в т.6 из жидкости начинают выделяться кристаллы В1. В т.7 оставшаяся жидкость состав т.S кристаллизуется в эвтектику. Ниже т.7 сплав состоит из В1+эвт (
Кристаллизация сплава 3: в т.6 из жидкости начинают выделяться кристаллы В1. В т.7 оставшаяся жидкость состав т.S кристаллизуется в эвтектику. Ниже т.7 сплав состоит из В1+эвт ( 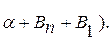
диаграмма 3 типа (3-й вариант) – рис. 5.13.а, б
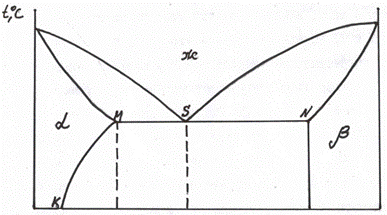
Рис. 5.13, а Диаграмма 3 типа (3-й вариант) – заполнены только однофазные области
Заполняем диаграмму, начиная с однофазных областей:  -раствор В и А;
-раствор В и А; 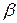 -раствор А и В и жидкость (рис. 5.13, а).
-раствор А и В и жидкость (рис. 5.13, а).
Остальные области двухфазные, поэтому заполняем, пользуясь правилом отрезков (рис. 5.13, б): в т.S образуется эвтектика из 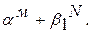 С понижением температуры из
С понижением температуры из  -раствора выделяются кристаллы
-раствора выделяются кристаллы 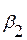 , т.к. растворимость падает по кривой МК. Заполненная диаграмма представлена на рис. 5.13, б.
, т.к. растворимость падает по кривой МК. Заполненная диаграмма представлена на рис. 5.13, б.
Рис. 5.13, б диаграмма 3 типа (3-й вариант)-
заполнены одно- и двухфазные области
Диаграмма состояния 4 типа(случай устойчивого химического соединения). Если компоненты вступают в химическое соединение, то на диаграмме появляется новое вещество и диаграмма разбивается на две (рис. 5.14).
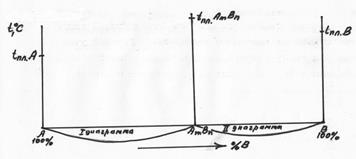
Рис. 5.14 Начало построения диаграммы 4 типа.
На каждом из этих участков диаграммы может быть диаграмма 1. 2 или 3 типа. Например, один из вариантов диаграммы 4 типа представлен на рис. 5.15.
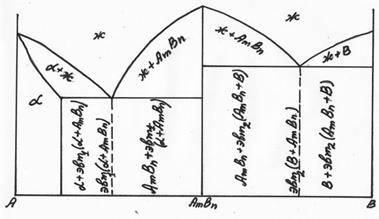
Рис. 5.15 Диаграмма 4 типа (один из вариантов)
Сначала заполняем однофазные области (ж) и (  ), затем в т.S и С определяем эвтектики (эвт.1 и эвт.2). Остальные области заполняем, пользуясь правилом отрезков (см. рис. 5.15).
), затем в т.S и С определяем эвтектики (эвт.1 и эвт.2). Остальные области заполняем, пользуясь правилом отрезков (см. рис. 5.15).
Дата добавления: 2017-01-26; просмотров: 8635;










