Рентгеновские уровни энергии
Таким образом, при удалении внутреннего электрона атом превращается в ион, обладающий запасом энергии, равным энергии связи удаленного электрона. Этот запас энергии и является, по существу, рентгеновским уровнем энергии. Поскольку электроны разных внутренних слоев имеют разные энергии связи, то в результате ионизации может возникнуть целый набор рентгеновских уровней.
На диаграмме рентгеновских уровней энергии выше всего расположится К-уровень, а значительно ниже будут лежать L-, M- и N-уровни (рис. 8.1).
Если принять границу ионизации внешнего электрона за нуль энергии, то оптические уровни (соответствующие основному и возбужденным состояниям нейтрального атома) попадут на диаграмме в область отрицательных значений энергии.
Отметим, что диапазон оптических уровней энергии обычно составляет не более 10 электронвольт, а диапазон рентгеновских уровней охватывает до нескольких десятков тысяч электронвольт (масштаб диаграммы на рис.1 не выдержан).
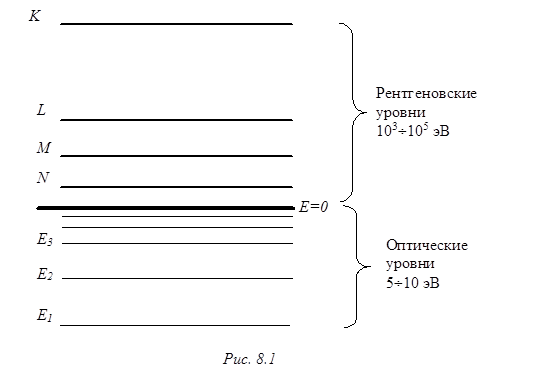
Сравним между собой схемы рентгеновских и оптических уровней. Между ними имеются существенные различия. Уровень с наименьшим главным квантовым числом 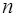 = 1 на схеме оптических уровней лежит ниже всех, тогда как на схеме рентгеновских уровней уровень с
= 1 на схеме оптических уровней лежит ниже всех, тогда как на схеме рентгеновских уровней уровень с 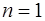 (т. е. К-уровень) лежит выше всех. Таким образом, схема рентгеновских уровней представляет собой обращение оптической схемы.
(т. е. К-уровень) лежит выше всех. Таким образом, схема рентгеновских уровней представляет собой обращение оптической схемы.
Более детальное рассмотрение показывает, что каждый рентгеновский уровень (кроме К-уровня) состоит из относительно близко расположенных подуровней. Дело в том, что энергия связи электрона зависит от трех его квантовых чисел (главного  , орбитального
, орбитального 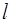 и квантового числа полного момента
и квантового числа полного момента 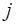 ) и этих наборов троек для электронов заданного слоя может быть несколько. Энергия рентгеновского подуровня
) и этих наборов троек для электронов заданного слоя может быть несколько. Энергия рентгеновского подуровня 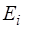 выражается формулой
выражается формулой
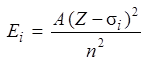 , ,
| (8.2) |
где индекс 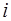 соответствует совокупности квантовых чисел
соответствует совокупности квантовых чисел 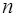 ,
, 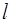 ,
, 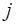 ; постоянная A = 13,6 эВ; Z – порядковый номер элемента;
; постоянная A = 13,6 эВ; Z – порядковый номер элемента; 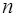 – главное квантовое число;
– главное квантовое число; 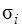 – постоянная экранирования, слабо зависящая от Z.
– постоянная экранирования, слабо зависящая от Z.
Зависимость энергии 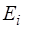 от главного квантового числа
от главного квантового числа 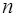 обусловлена электростатическим взаимодействием данного электрона с ядром и другими электронами атома, от орбитального числа
обусловлена электростатическим взаимодействием данного электрона с ядром и другими электронами атома, от орбитального числа 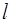 – разной степенью влияния на это взаимодействие других электронов, а от числа
– разной степенью влияния на это взаимодействие других электронов, а от числа 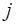 – спин-орбитальным взаимодействием, имеющим магнитную природу. Основной вклад в энергию связи электрона вносит его кулоновское взаимодействие с ядром. Величина этого вклада совпадает с энергией связи электрона в водородоподобной системе и равна
– спин-орбитальным взаимодействием, имеющим магнитную природу. Основной вклад в энергию связи электрона вносит его кулоновское взаимодействие с ядром. Величина этого вклада совпадает с энергией связи электрона в водородоподобной системе и равна 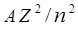 . Наличие остальных электронов уменьшает эту энергию – они как бы «заслоняют» или экранируют данный электрон от ядра, что формально можно выразить как уменьшение заряда ядра Z на величину
. Наличие остальных электронов уменьшает эту энергию – они как бы «заслоняют» или экранируют данный электрон от ядра, что формально можно выразить как уменьшение заряда ядра Z на величину 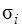 , характеризующую степень экранирования. Замена фактического заряда ядра Z эффективным зарядом
, характеризующую степень экранирования. Замена фактического заряда ядра Z эффективным зарядом 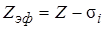 и приводит к формуле (8.2).
и приводит к формуле (8.2).
Вклад спин-орбитального взаимодействия в энергию связи пропорционален 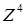 с очень малым коэффициентом. Этот вклад относительно мал для легких и средних элементов, но оказывается заметным для элементов, находящихся в конце периодической системы.
с очень малым коэффициентом. Этот вклад относительно мал для легких и средних элементов, но оказывается заметным для элементов, находящихся в конце периодической системы.
Характер зависимости 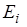 от квантовых чисел таков, что по мере увеличения каждого из трех квантовых чисел энергия
от квантовых чисел таков, что по мере увеличения каждого из трех квантовых чисел энергия 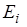 убывает. Сильнее всего
убывает. Сильнее всего 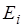 зависит от главного квантового числа
зависит от главного квантового числа 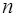 , поэтому тесно расположенные подуровни, относящиеся к данному
, поэтому тесно расположенные подуровни, относящиеся к данному 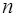 , отделены от подуровней, относящихся к n ± 1 большими энергетическими интервалами.
, отделены от подуровней, относящихся к n ± 1 большими энергетическими интервалами.
Нетрудно найти возможные значения трех квантовых чисел электрона из внутренних слоев. Каждому такому набору отвечает спектральный терм и рентгеновский подуровень энергии (табл. 8.1).
Таблица 8.1
| Слой | K | L | M | ||||||
| n | |||||||||
| l | |||||||||
| j | 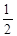
| 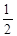
| 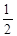
| 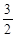
| 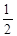
| 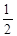
| 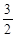
| 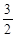
| 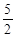
|
| Терм | 1S1/2 | 2S1/2 | 2P1/2 | 2P3/2 | 3S1/2 | 3P1/2 | 3P3/2 | 3D3/2 | 3D5/2 |
| Подуро-вень | K | L1 | L2 | L3 | M1 | M2 | M3 | M4 | M5 |
Эти же наборы квантовых чисел относятся и к рентгеновскому иону, т.е. к атому с дыркой в соответствующем слое. Действительно, внутренние оболочки исходного атома замкнуты; их орбитальный и спиновый моменты импульса равны нулю, и оболочка, из которой был удален электрон, приобретает момент, равный по модулю и противоположный по направлению моменту этого электрона.
Из табл. 8.1 видно, что рентгеновский уровень состоит из 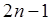 подуровней, так что нерасщепленным оказывается только К-уровень. Диаграмма рентгеновских уровней с учетом их расщепления изображена на рис. 8.2.
подуровней, так что нерасщепленным оказывается только К-уровень. Диаграмма рентгеновских уровней с учетом их расщепления изображена на рис. 8.2.
Обращает на себя внимание, что эта диаграмма аналогична «перевернутой» диаграмме для атомов щелочных элементов.
Отметим, что в главных своих чертах диаграмма рентгеновских уровней одинакова для всех элементов. Однако для легких элементов она короче, чем для тяжелых, за счет отсутствия части нижних уровней. Это связано с тем, что в атомах легких элементов меньше электронов, а следовательно, и замкнутых электронных оболочек.
Излучательные переходы, образующие характеристический рентгеновский спектр, возможны лишь между теми рентгеновскими уровнями, которые отвечают правилам отбора, таким же как и для оптических спектров щелочных атомов
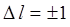 ; ; 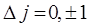 . .
| (8.3) |

Некоторые переходы, удовлетворяющие правилам отбора (8.3), изображены на рис. 8.2 стрелками. Характеристический спектр состоит из серий спектральных линий, которые обозначаются буквами K, L, M, N,… по верхнему из уровней. Так, K-серия возникает при переходах с К-уровня на лежащие ниже L-, M-, и N-подуровни; L-серия – при аналогичных переходах с L-подуровней; M-серия – при переходах с М-подуровней и т. д. (на рис. 8.2 представлены лишь две спектральные серии: K и L).
Из приведенного объяснения возникновения характеристического рентгеновского излучения следует, что при выбивании наиболее прочно связанных электронов из К-слоя возникает не только К-серия, но и весь рентгеновский спектр. Вообще при возбуждении какой-либо серии или линии рентгеновского излучения появляются также все серии и линии с бóльшими длинами волн.
8.4. Закон Мозли
Обратимся к формуле (8.2) для энергии рентгеновских подуровней. В этой формуле постоянная экранирования 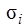 очень слабо зависит от порядкового номера элемента Z, но заметным образом – от квантовых чисел
очень слабо зависит от порядкового номера элемента Z, но заметным образом – от квантовых чисел 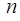 и
и 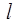 . Для электронов К-слоя экранирующее действие остальных электронов наименьшее и постоянная экранирования
. Для электронов К-слоя экранирующее действие остальных электронов наименьшее и постоянная экранирования 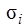 невелика: от 2 до 3. Электроны L-слоя экранируются сильнее, и для них
невелика: от 2 до 3. Электроны L-слоя экранируются сильнее, и для них 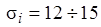 . Точные значения
. Точные значения 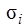 могут быть определены только экспериментально.
могут быть определены только экспериментально.
Энергия рентгеновских квантов, в соответствии с правилом частот Бора (8.3) равна:
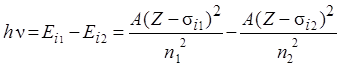 . .
| (8.4) |
Вследствие очень большого различия значений 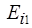 и
и 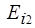 оказывается возможным ввести эмпирические постоянные экранирования прямо для спектральных линий. Тогда последняя формула приобретает более простой вид
оказывается возможным ввести эмпирические постоянные экранирования прямо для спектральных линий. Тогда последняя формула приобретает более простой вид
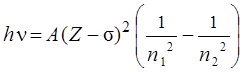 , ,
| (8.5) |
где эмпирическая постоянная экранирования 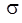 остается почти одинаковой для одних и тех же линий в спектрах разных элементов. В результате, из (8.5) следует, что квадратный корень частоты рентгеновской линии растет линейно с ростом Z:
остается почти одинаковой для одних и тех же линий в спектрах разных элементов. В результате, из (8.5) следует, что квадратный корень частоты рентгеновской линии растет линейно с ростом Z:
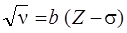 , ,
| (8.6) |
причем 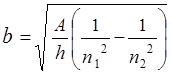 есть величина постоянная для данной спектральной линии. Эта закономерность была экспериментально открыта в 1913 г английским физиком Г. Мозли и получила название закона Мозли.
есть величина постоянная для данной спектральной линии. Эта закономерность была экспериментально открыта в 1913 г английским физиком Г. Мозли и получила название закона Мозли.
Закон Мозли сыграл решающую роль в установлении физического смысла порядкового номера элемента в периодической системе Менделеева. Кроме того, с его помощью были найдены правильные порядковые номера некоторых элементов. В частности, Мозли поменял порядковые номера у никеля и кобальта (до этого никель Ni имел меньший порядковый номер, чем кобальт Co), а также оставил место для элемента с порядковым номером Z = 43 (технеция), который в то время не был известен.
Дата добавления: 2021-05-28; просмотров: 145;










