Сущность и виды катализа
Катализом называется изменение скорости химических реакций под воздействием веществ – катализаторов, которые участвуют в процессе, вступая в промежуточное химическое взаимодействие с реагентами, но остаются после окончания каталитического акта химически неизменными.
Катализаторами могут быть вещества, находящиеся в любом из трех агрегатных состояний – газы, жидкости и твердые тела.
Каталитические процессы можно разделить на две группы: гомогенные и гетерогенные. Если в присутствии катализатора реакция ускоряется, то это явление называют положительным катализом или просто катализом. Если реакция замедляется – антикатализаторы или ингибиторы.
Сущность катализа одинакова для всех его видов – гомогенного, гетерогенного, но каждый из этих видов имеет свои отличительные особенности. В общем случае ускоряющее действие катализаторов принципиально отличается от действия других факторов, интенсифицирующих химические процессы – температура, давление. Так, при повышении температуры повышается температура реагирующих молекул за счет вводимой извне теплоты.
При внесении катализатора энергетический уровень реагирующих молекул не меняется. Действие катализатора не смещает равновесие простой реакции, а лишь ускоряет достижение равновесия при данной температуре.
Для процессов, протекающих в кинетической области, скорость реакции
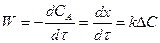
Т. к. ΔС не меняется для каталитической и некаталитической реакции, то действие катализатора состоит в повышении константы скорости реакции.
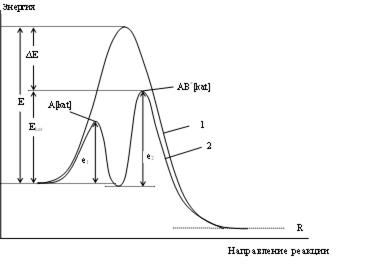
Наиболее распространенной теорией, служащей основой современных представлений о катализе, является теория промежуточных соединений. Согласно этой теории, медленную стадию между исходными веществами можно заменить двумя или несколькими более быстрыми стадиями с участием катализатора, который образует с исходными веществами непрочные соединения. Скорость реакции тем больше, чем меньше энергия активации вследствие экспоненциальной зависимости
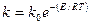
Изменение энергии реагирующей системы при некаталитической (1) и каталитической (2) реакции
Рассмотрим энергетическую картину реакционной системы, например для бимолекулярной реакции
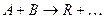 ,
,
проходящей в отсутствие катализатора по схеме
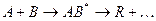
через образование активного комплекса АВ*. В присутствии катализатора реакция едет по другому пути через несколько элементарных стадий:
А + [kat] = A[kat]
A[kat] + B = AB*[kat]
AB*[kat] = R + [kat] . . .
Е – энергия активации некаталитической реакции;
Екат – каталитической реакции;
е1 и е2 – энергии активации промежуточных стадий.
Активность катализаторов
Наиболее важной характеристикой катализаторов является их активность, т. к. мера ускоряющего действия катализатора по отношению к данной реакции
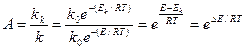
Рассмотрим на примере окисления сернистого ангидрида
2SO2 + O2 = 2SO3 + Q
Энергии активации при 420о С (693 К) составляет 420000 Дж/моль. На ванадиевом катализаторе V2O5 Ek = 268 кДж/моль К. R = 8,3 Дж/моль К.
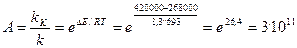
Селективность (избирательность катализаторов)
Избирательность действия – важнейшая особенность катализаторов, которая определила успех их широкого применения в ряде отраслей промышленности. Особенно важен он в производстве органических продуктов, когда селективность позволяет сильно ускорять одну полезную реакцию, проводить процесс при погниженной температуре, подавляя другие реакции.
Селективность действия катализатора Iкат можно выразить отношением скорости образования целевого продукта к суммарной скорости превращения основного исходного вещества.
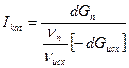 ,
,
где Gп – количество продукта;
υп υисх – соотношение стехиометрических коэффициентов при образовании продуктов из основного исходного вещества.
Общую интегральную селективность действия катализаторов можно выразить соотношением
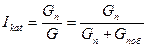 .
.
где G – общее количество исходного вещества, моль;
Gпоб - количество исходного вещества, вступившего в побочные реакции;
Gп - количество исходного вещества, превратившегося в целевой продукт.
Особенно сильно проявляется селективность в сложных органических реакциях. Так, например, этиловый спирт в зависимости от типа катализатора может превращаться в этилен
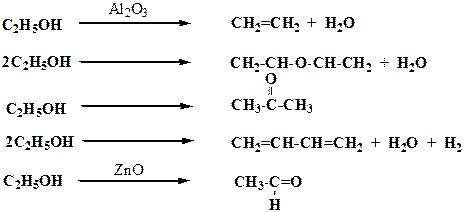
Следовательно, из одного и того же сырья возможно получить различные целевые продукты.
Дата добавления: 2017-01-08; просмотров: 4278;










