Методы определения порядка реакции
Порядок реакции является эмпирической величиной и не может быть рассчитан теоретически, если не известен механизм реакции. Порядок реакции определяют, используя экспериментальные данные об изменении концентрации реагирующих веществ со временем. Методы определения порядка подразделяют на интегральные и дифференциальные в зависимости от того, используются интегральные или дифференциальные кинетические уравнения (см. табл. 1) для обработки опытных данных.
К интегральным методам относятся метод подстановки (аналитический и графический), метод времени полупревращения и метод Оствальда-Нойеса.
Метод подстановкизаключается в том, что экспериментальные данные последовательно подставляют в интегральные кинетические уравнения для реакций целых порядков (от нулевого до третьего) и рассчитывают константу скорости. Если для выбранного порядка рассчитанные значения k приблизительно постоянны (с учетом разброса экспериментальных данных), то изучаемая реакция имеет данный порядок. Если же значения константы скорости систематически возрастают или убывают, то расчет повторяют для другого порядка. Если ни одно из кинетических уравнений не дает удовлетворительного результата, то есть порядок реакции не является целым, это означает, что реакция протекает по более сложному механизму.
Графический вариант метода подстановки заключается в представлении экспериментальных данных в соответствующих координатах с целью получения линейной зависимости текущей концентрации от времени.
Для 0 порядка: 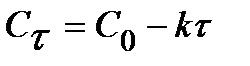 . (10)
. (10)
Для 1 порядка: 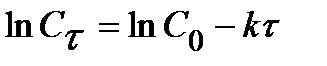 . (11)
. (11)
Для 2 порядка: 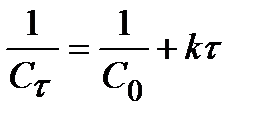 . (12)
. (12)
Для 3 порядка: 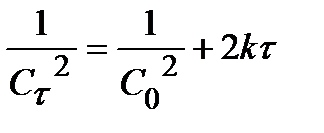 . (13)
. (13)
Если в координатах, соответствующих одному из порядков, получается линейная зависимость от времени, то изучаемая реакция имеет данный порядок. Одновременно из тангенса угла наклона прямой в этом случае можно получить значение константы скорости (рис. 1, 2, 3, 4).
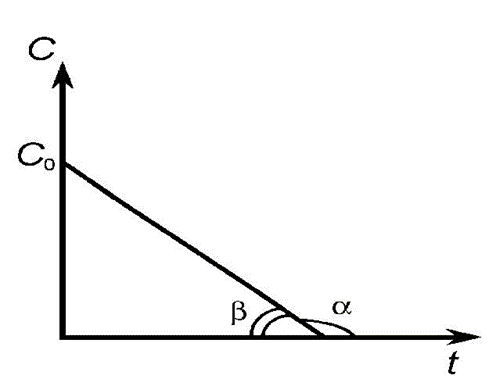
Рис. 1. Зависимость концентрации исходного вещества от времени для реакции нулевого порядка

Рис. 2. Зависимость lnC = f(t) для реакции первого порядка
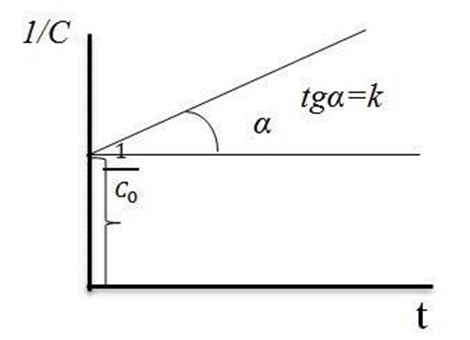
Рис. 3. Зависимость 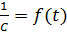 для реакции второго порядка
для реакции второго порядка
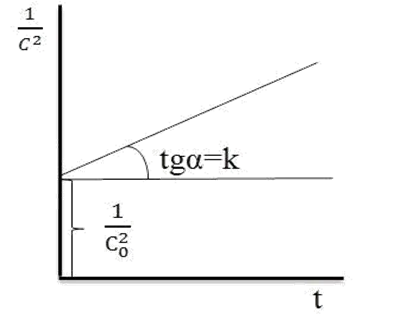
Рис. 4. Зависимость 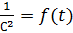 для реакции третьего порядка
для реакции третьего порядка
Метод подстановки дает надежные результаты для больших значений степени превращения исходных веществ.
Метод времени полупревращения. Период полураспада для реакций различного порядка по-разному зависит от начальной концентрации реагентов (см. табл. 1). Для реакции нулевого порядка τ1/2 прямо пропорционален начальной концентрации С0, для реакции первого порядка – не зависит от начальной концентрации С0, для реакции второго порядка – обратно пропорционален С0, а для реакции третьего порядка – обратно пропорционален С02. Проводят эксперименты с различными начальными концентрациями реагирующих веществ, определяют τ1/2 , строят графические зависимости τ1/2 = f(С0) в соответствующих координатах. Получение линейной зависимости свидетельствует о том, что реакция имеет данный порядок, а угловой коэффициент прямой позволяет найти константу скорости реакции.
Если порядок реакции равен дробной величине, то его можно определить графически по времени полупревращения реакции n-ного порядка
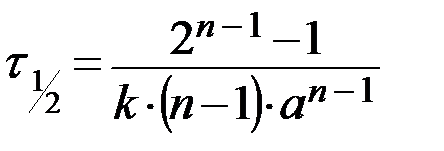 . (14)
. (14)
Логарифмируя это уравнение, получим уравнение прямой
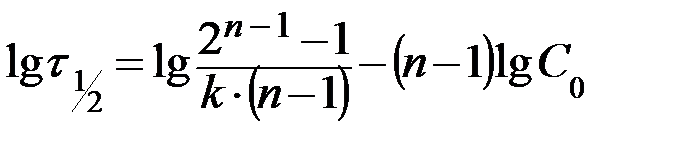 . (15)
. (15)
По экспериментальным данным о τ1/2 и С0 строят график в координатах lgτ1/2 - lg(С0) – (рис. 5), получают прямую линию, тангенс угла наклона которой к оси абсцисс tgα = n – 1 n = tgα + 1.
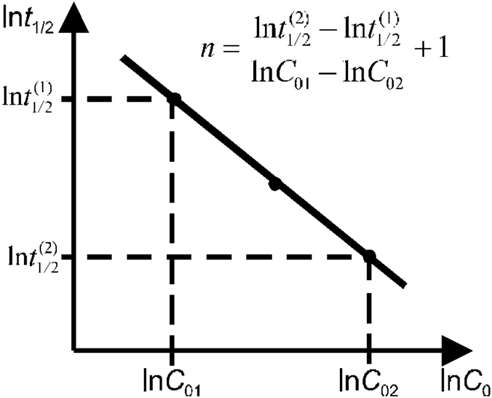
Рис.5. Зависимость 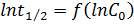
В методе Оствальда-Нойеса используют зависимость времени превращения τα от начальной концентрации исходного вещества, где α - определенная глубина протекания реакции (α = 1/2, 1/3, 1/4 и т. д.). Порядок реакции рассчитывают по следующему уравнению:
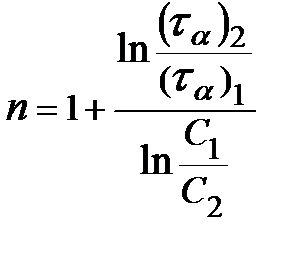 . (16)
. (16)
Частным случаем метода Оствальда-Нойеса является метод определения порядка реакции по периоду полупревращения:
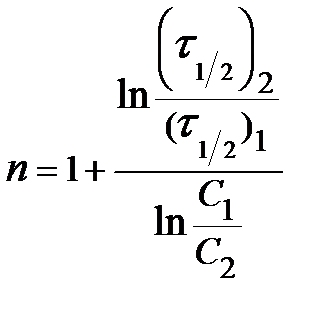 . (17)
. (17)
Методы Оствальда-Нойеса и времени полураспада позволяют определять любые порядки реакций, включая дробные и отрицательные.
К дифференциальнымметодам определения порядка относятся метод избытка или изоляции Оствальда и метод Вант-Гоффа.
Если кинетическое уравнение реакции имеет вид
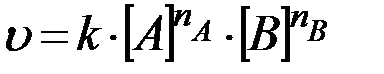 , (18)
, (18)
то для определения частного порядка по одному из веществ используют метод избытка или изоляции Оствальда. Суть метода состоит в том, что зависимость скорости реакции от начальной концентрации одного из реагентов (например, вещества А) изучают при большом избытке второго реагента В. В этом случае концентрация вещества В остается в течение реакции практически постоянной, и уравнение (18) приобретает вид
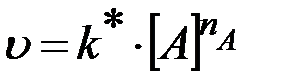 , (19)
, (19)
где 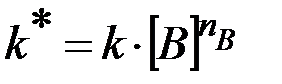 .
.
Логарифмируя уравнение (19), получим уравнение прямой линии
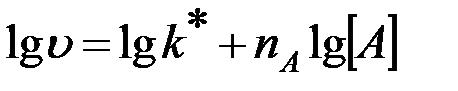 , (20)
, (20)
из тангенса угла наклона которой определяют порядок реакции, а из отсекаемого отрезка – константу скорости (рис. 6). Различные значения υ и 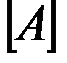 могут быть получены из одной кинетической кривой
могут быть получены из одной кинетической кривой 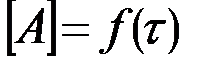 (рис. 7), где скорость реакции в данный момент времени рассчитывается как тангенс угла наклона касательной в этой точке.
(рис. 7), где скорость реакции в данный момент времени рассчитывается как тангенс угла наклона касательной в этой точке.
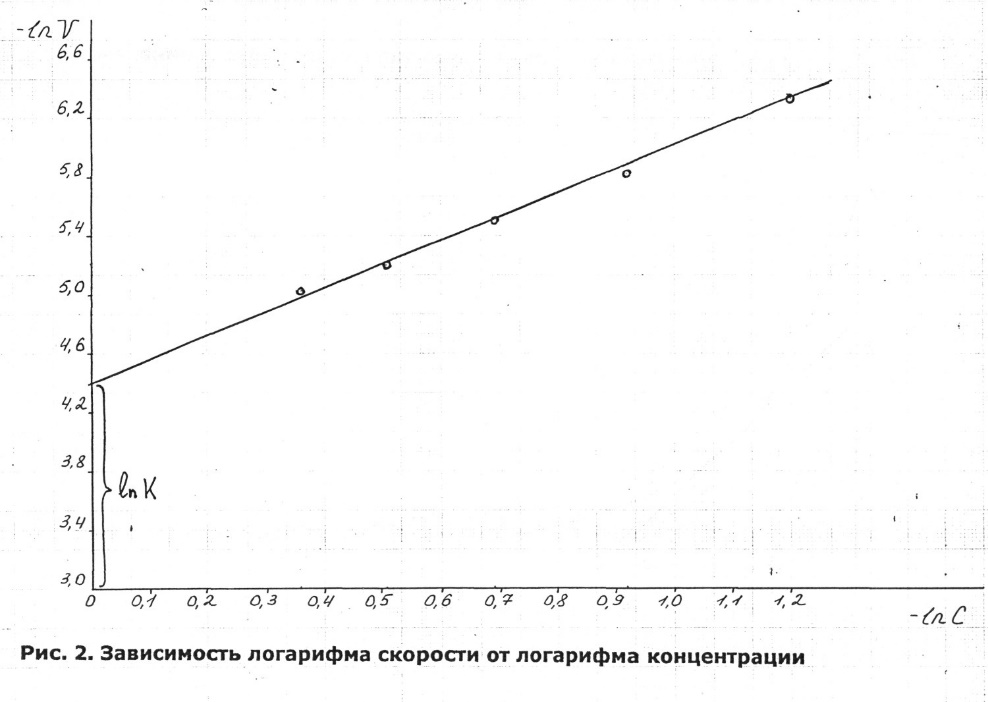
Рис. 6. Зависимость lnυ=f(lgC)
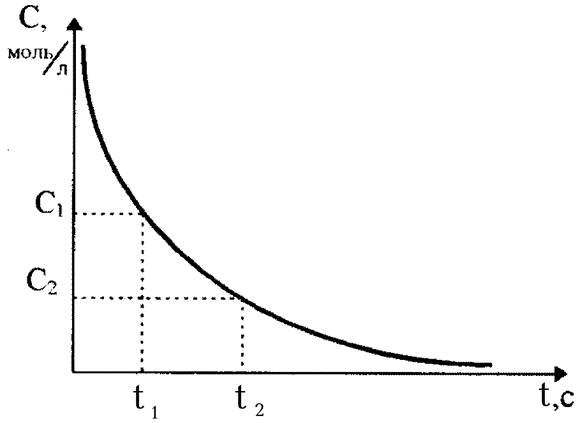
Рис. 7. Зависимость изменения концентрации вещества во времени
Метод Вант-Гоффа также основан на уравнении (20) и позволяет по двум значениям скорости реакции при двух концентрациях вещества А определить порядок реакции:
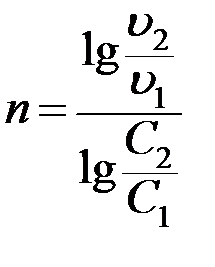 . (21)
. (21)
Дата добавления: 2021-04-21; просмотров: 1213;










