Распределение Больцмана
В барометрической формуле в отношении M/R разделим и числитель и знаменатель на число Авогадро 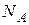 .
.
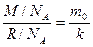 , где
, где
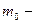 масса одной молекулы,
масса одной молекулы,
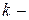 постоянная Больцмана.
постоянная Больцмана.
Вместо Р и 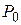 подставим соответственно.
подставим соответственно. 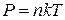
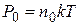 (см. лекцию №7), где
(см. лекцию №7), где 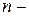 плотность молекул на высоте h,
плотность молекул на высоте h, 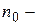 плотность молекул на высоте
плотность молекул на высоте 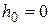 .
.
Из барометрической формулы в результате подстановок и сокращений получим распределение концентрации молекул по высоте в поле силы тяжести Земли.
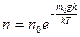
|
Из этой формулы следует, что с понижением температуры число частиц на высотах, отличных от нуля, убывает (рис. 8.10), обращаясь в 0 при Т=0 (при абсолютном нуле все молекулы расположились бы на поверхности Земли). При высоких температурах n слабо убывает с высотой, так
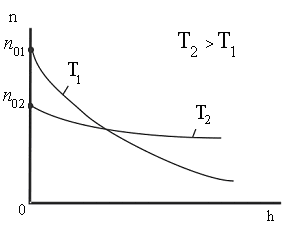
| что молекулы оказываются распределёнными по высоте почти равномерно. Распределение молекул по высоте является результатом конкуренции между притяжением молекул к Земле и тепловым движением, стремящимся разбросать молекулы по всем высотам. На разной высоте молекула обладает различным запасом потенциальной энергии |
| Рис. 8.10 |
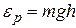 .Следовательно, распределение молекул по высоте является и распределением их по значениям потенциальной энергии.
.Следовательно, распределение молекул по высоте является и распределением их по значениям потенциальной энергии.
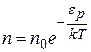
| (*) |
где 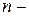 плотность молекул в том месте пространства, где потенциальная энергия молекулы имеет значение
плотность молекул в том месте пространства, где потенциальная энергия молекулы имеет значение 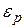 ;
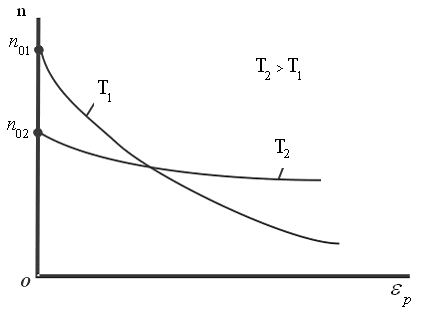
; 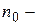 плотность молекул в том месте, где потенциальная энергия равна 0.
плотность молекул в том месте, где потенциальная энергия равна 0.
Больцман доказал, что распределение (*) справедливо не только в случае потенциального поля сил земного тяготения, но и в любом потенциальном поле сил для совокупности любых одинаковых частиц, находящихся в состоянии хаотического теплового движения.
Таким образом, закон Больцмана (*) даёт распределение частиц, находящихся в состоянии хаотического теплового движения, по значениям потенциальной энергии. (рис. 8.11)
| |
| Рис. 8.11 |
4. Распределение Больцмана при дискретных уровнях энергии.
Полученное Больцманом распределение относится к случаям, когда молекулы находятся во внешнем поле и их потенциальная энергия 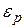 может применяться непрерывно. Больцман обобщил полученный им закон на случай распределения, зависящего от внутренней энергии молекулы.
может применяться непрерывно. Больцман обобщил полученный им закон на случай распределения, зависящего от внутренней энергии молекулы.
Известно, что величина внутренней энергии молекулы (или атома) Е может принимать лишь дискретный ряд дозволенных значений 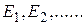 . В этом случае распределение Больцмана имеет вид:
. В этом случае распределение Больцмана имеет вид:
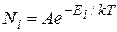 ,
,
где 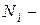 число частиц в состоянии с энергией
число частиц в состоянии с энергией 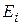 ;
;
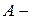 коэффициент пропорциональности, который удовлетворяет условию
коэффициент пропорциональности, который удовлетворяет условию
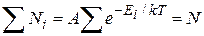 ,
,
где N – полное число частиц в рассматриваемой системе.
Тогда 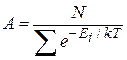 и в результате для случая дискретных значений энергии распределение Больцмана
и в результате для случая дискретных значений энергии распределение Больцмана
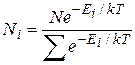
|
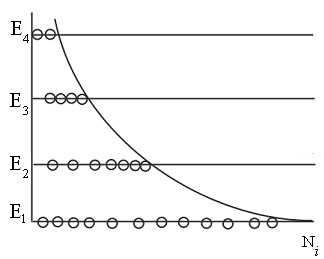
| Качественная иллюстрация этого распределения представлена на рис. 8.12. Это распределение характерно для состояния термодинамического равновесия. Заметим, что в активных средах лазеров населённость уровней с большим значением энергии может быть выше, чем с меньшим. Это так называемая инверсная населённость уровней. |
| Рис. 8.12 |
Но состояние системы в этом случае термодинамически неравновесное.
5. Статистика Максвелла-Больцмана
Распределение Максвелла и Больцмана можно объединить в один закон Максвелла-Больцмана, согласно которому число молекул, компоненты скорости которых лежат в пределах от 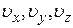 до
до 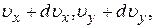
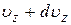 , а координаты в пределах от x, y, z до x+dx, y+dy, z+dz, равно
, а координаты в пределах от x, y, z до x+dx, y+dy, z+dz, равно
 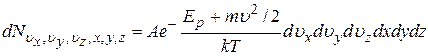
|
где 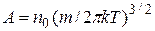 ,
, 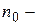 плотность молекул в том месте пространства, где
плотность молекул в том месте пространства, где 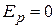 ;
; 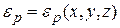 ;
; 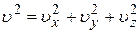 ;
; 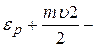 полная механическая энергия частицы.
полная механическая энергия частицы.
Распределение Максвелла-Больцмана устанавливает распределение молекул газа по координатам и скоростям при наличии произвольного потенциального силового поля.
Примечание: распределение Максвелла и Больцмана являются составными частями единого распределения, называемого распределением Гиббса (этот вопрос подробно рассматривается в спецкурсах по статической физике, и мы ограничимся только упоминанием этого факта).
Вопросы для самоконтроля.
1. Дайте определение вероятности.
2. Каков смысл функции распределения?
3. Каков смысл условия нормировки?
4. Запишите формулу для определения среднего значения результатов измерения величины x с помощью функции распределения.
5. Что представляет собой распределение Максвелла?
6. Что такое функция распределения Максвелла? Каков ее физический смысл?
7. Постройте график функции распределения Максвелла 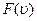 и укажите характерные особенности этой функции.
и укажите характерные особенности этой функции.
8. Укажите на графике 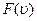 наиболее вероятную скорость
наиболее вероятную скорость 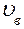 . Получите выражение для
. Получите выражение для 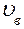 . Как изменяется график
. Как изменяется график 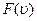 при повышении температуры?
при повышении температуры?
9. Получите барометрическую формулу. Что она определяет?
10. Получите зависимость концентрации молекул газа в поле силы тяжести от высоты.
11. Запишите закон распределения Больцмана а) для молекул идеального газа в поле силы тяжести; б) для частиц массой m, находящихся в роторе центрифуги, вращающейся с угловой скоростью 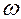 .
.
12. Объясните физический смысл распределения Максвелла-Больцмана.
Лекция №9
Реальные газы
План
1. Силы межмолекулярного взаимодействия в газах. Уравнение Ван-дер-Ваальса. Изотермы реальных газов.
2. Метастабильные состояния. Критическое состояние.
3. Внутренняя энергия реального газа.
4. Эффект Джоуля – Томсона. Сжижение газов и получение низких температур.
1. Силы межмолекулярного взаимодействия в газах
Многие реальные газы подчиняются законам идеальных газов при нормальных условиях. Воздух можно считать идеальным до давлений ~ 10 атм. При повышении давления отклонения от идеальности (отклонение от состояния, описываемого уравнением Менделеева - Клайперона) возрастают и при p=1000 атм достигают более 100%.
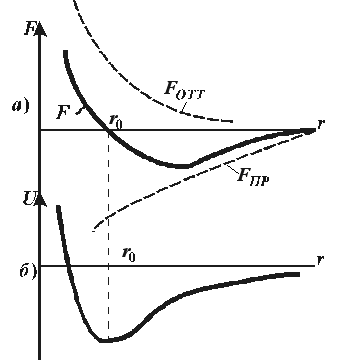
| Дело в том, что между молекулами действуют значительные по величине силы, называемые молекулярными силами. При удалении молекул друг от друга молекулярное взаимодействие проявляется в виде сил притяжения, при сближении – в виде сил отталкивания. Молекулярные силы имеют электромагнитное и квантовое происхождение. На рис. 9.1 а) представлена качественная зависимость сил межмолекулярного взаимодействия от расстояния r между молекулами, где Fотт и Fпр – соответственно силы отталкивания |
| Рис. 9.1 |
и притяжения, а F – их результирующая. Силы отталкивания считаются положительными, а силы взаимного притяжения – отрицательными. Соответствующая качественная кривая зависимости энергии взаимодействия молекул от расстояния r между центрами молекул приведена на
рис. 9.1б). На малых расстояниях 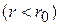 молекулы отталкиваются, на больших
молекулы отталкиваются, на больших 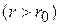 притягиваются. Быстро возрастающие на малых расстояниях силы отталкивания означают грубо говоря, что молекулы как бы занимают некоторый определённый объём, дальше которого газ не может быть сжат.
притягиваются. Быстро возрастающие на малых расстояниях силы отталкивания означают грубо говоря, что молекулы как бы занимают некоторый определённый объём, дальше которого газ не может быть сжат.
Дата добавления: 2016-12-27; просмотров: 6920;










