Соотношение между составом пара и жидкости в простейших системах. Законы Коновалова и Вревского.
Правило рычага Алексеева.
Кроме состава каждой равновесной фазы в случае двухфазной системы, по диаграмме можно также определить массовое соотношение между фазами. Расчет количества равновесных фаз основан на правиле рычага.
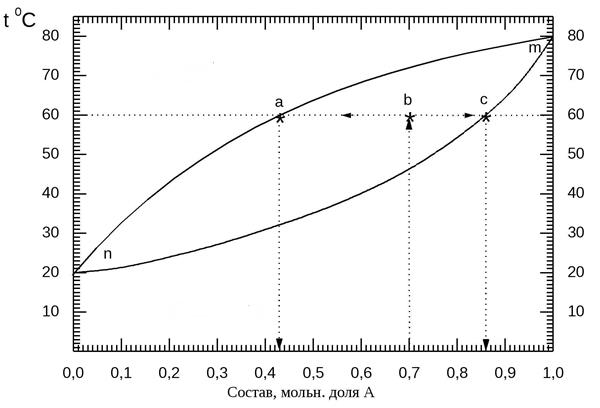
Рассмотрим данное правило на диаграмме состав – температура кипения. При температуре Т1 (60 оС) состав жидкости определяется точкой с, а состав пара точкой а. Общий состав любых гетерогенных систем, существующих при данной температуре, описывается точками, лежащими на прямой, соединяющей а и с. Положение точки будет определяться количеством каждой из фаз. Если обе фазы взять в одинаковом количестве, то точка, описывающая систему расположится точно посередине между с и а. Если количество жидкой фазы в три раза больше, чем пара, то точка системы ближе к с так, что расстояние от нее до а будет в три раза больше, чем до с.
В общем случае, если количества жидкости и пара равны соответственно nП и nЖ молей, то отношение отрезков ab и bc, отсекаемых точкой b гетерогенной системы, будет равно
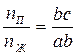
Таким образом, мы имеет полную аналогию с механическим рычагом, находящимся в равновесии, если в фигуративной точке b мы поместим упор, а на концах рычага поместим массы соответствующих фаз. Поэтому соотношение и называется правилом рычага.
Формулировка:
Точка, отвечающая составу гетерогенной двойной системы, располагается на прямой, соединяющей точки сосуществующих фаз. При этом отрезки, отсекаемые на прямой этой точкой обратно пропорциональны количеству каждой из фаз.
|
|
|
|
Выведем правило рычага теоретически. Пусть имеется n молей раствора, содержащего компоненты А и В и пусть в нем содержится N мольных долей компонента А. Следовательно, взятое количество раствора содержит N*n компонента А и n(1-N) компонента В.
Раствор нагреваем до температуры Т1 = 60оС (точка b). Этот раствор разложится на паровую (а) и жидкую (с) фазы. Количество паровой фазы обозначим как nП, жидкой nЖ, при этом nЖ = (n – nП).
Мольная доля компонента А в в парах равна N1, в жидкости N3. Тогда количество компонента А в парах N1nП, в жидкости N3(n – nП).
Так как количество компонента до и после нагревания остается постоянным, можно записать:
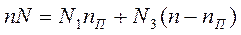
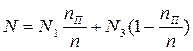 è
è 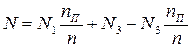
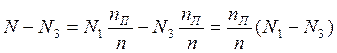
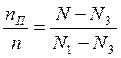 (1)
(1)
Выразим соотношение для жидкой фазы, вычтем правую и левую часть из 1.
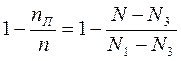
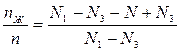
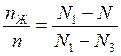 (2) Разделим (1) на (2):
(2) Разделим (1) на (2):
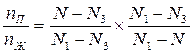
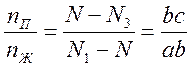
Соотношение между составом пара и жидкости в простейших системах. Законы Коновалова и Вревского.
Если оба компонента в чистом состоянии летучи, то пар будет содержать оба компонента. Однако относительное содержание компонентов в парах в общем случае будет отличаться от относительного содержания их в жидкости.
Только в системе, компоненты которой обладают одинаковым давлением пара в чистом состоянии, т.е. при 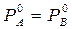 , состав пара над раствором равен составу раствора. В остальных случаях состав пара отличается от состава раствора в тем большей степени, чем больше различаются их Р0.
, состав пара над раствором равен составу раствора. В остальных случаях состав пара отличается от состава раствора в тем большей степени, чем больше различаются их Р0.
В простейших системах в парах по сравнению с жидкостью всегда преобладает тот компонент, который имеет большее давление пара в чистом состоянии.
Зависимость состава пара от давления можно вывести следующим образом: пусть N’A и N’B – мольные доли компонентов в парах, NA и NB – мольные доли компонентов в жидкости.
Мольные доли компонентов в парах определяются отношением парциального давления к общему: 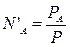 ;
; 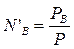 .
.
Парциальное давление по закону Рауля: 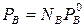 . С учетом этих уравнений найдем отношение мольных долей веществ в парах через мольные доли компонентов в жидкости. Для этого разделим N’A на N’B и подставим в полученное выражение уравнение Рауля:
. С учетом этих уравнений найдем отношение мольных долей веществ в парах через мольные доли компонентов в жидкости. Для этого разделим N’A на N’B и подставим в полученное выражение уравнение Рауля:
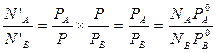
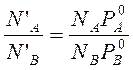 на основе этой зависимости сформулированы законы Коновалова и Вревского.
на основе этой зависимости сформулированы законы Коновалова и Вревского.
В конце XIX века известным русским ученым Д.П. Коноваловым была исследована зависимость состава пара от состава раствора и общего давления. В результате исследований были сделаны два важнейших вывода, которые впоследствии подтвердились термодинамическим путем и получили название законов Коновалова.
Первый закон Коновалова характеризует равновесное состояние жидкости и пара и состоит из двух положений:
1. Повышение относительного содержания данного компонента в жидкой фазе всегда вызывает увеличение относительного содержания его и в парах.
2. В двойной системе пар, по сравнению с находящейся в равновесии с ним жидкостью, относительно богаче тем из компонентов, прибавление которого к системе повышает общее давление пара (и понижает температуру кипения смеси).
Второй закон Коновалова касается случаев систем с азеотропными смесями:
В экстремальных точках состав жидкого раствора одинаков с составом пара, находящимся в равновесии с раствором.
Работами Вревского было показано, что зависимость состава пара от температуры определяется главным образом соотношением теплот испарения (уравнение Клаузиуса-Клапейрона для жидких систем).
Вревским было установлено три закона:
1. При повышении температуры раствора в равновесных парах повышается относительное содержание того компонента, парциальная мольная теплота испарения которого больше.
2. В азеотропной смеси с максимумом на кривой давления пара при повышении температуры возрастает концентрация компонента с большей парциальной мольной теплотой испарения. В азеотропной смеси с минимумом на кривой давления пара при повышении температуры возрастает концентрация компонента с меньшей парциальной мольной теплотой испарения. (Этот закон особенно важен при разработке процессов азеотропной ректификации).
3. В системах, обладающих максимумом на кривой давления пара, при изменении температуры состав пара, находящегося в равновесии с раствором, и состав азеотропной смеси изменяются в одном направлении. Если же кривая давления имеет минимум, то при изменении температуры состав пара, находящегося в равновесии с раствором постоянного состава, и состав азеотропной смеси изменяются в противоположных направлениях.
На законах Коновалова и Вревского основана вся теория и практика дистилляции и фракционная перегонка жидкостей, которая широко используется при разработке процессов разделения жидких смесей и очистки веществ.
Дистилляция.
Дистилляцией называется процесс разделения раствора на те или иные составные части путем перегонки. В основе метода лежит различие в составах равновесных жидкости и пара.
Разделение осуществляется тем легче, чем больше различаются по составу равновесные жидкость и пар.
Для количественной оценки пользуются величиной, получившей название коэффициента разделения α.
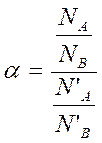 или
или 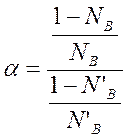
NB – мольная доля компонента в жидкости;
N’B – мольная доля компонента в паре.
В простейших случаях коэффициент разделения не зависит от состава и определяется: 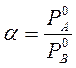 .
.
В остальных системах это соотношение находится в более сложной зависимости и будет в сильной степени зависеть от состава.
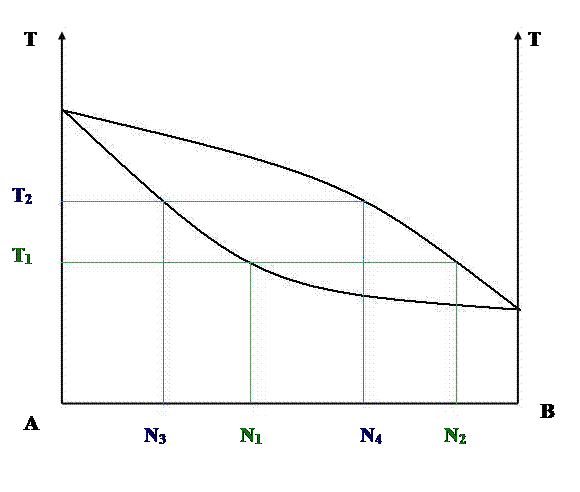
Сущность простой перегонки разберем на диаграмме «состав-температура кипения» без экстремумов.
 | |||
|
Если состав исходной смеси изображается точкой N1, то кипение начинается тогда, когда будет достигнута температура Т1 и состав первых порций пара изобразится точкой N2.
Он более богат компонентом В, чем жидкий раствор, поэтому после испарения некоторого количества раствора остающаяся часть его становится богаче компонентом А и имеет, например, состава N3. Данная смесь кипит при более высокой температуре (Т2).
Пар, находящийся в равновесии с раствором N3, обладает составом N4. Он тоже более богат компонентом В, чем раствор. Поэтому остаток раствора обогащается компонентом А и температура кипения повышается. В результате в остатке будет содержаться практически чистый компонент А, а температура кипения достигнет ТА.
Если пар, выделившийся из раствора, например, пар состава N2, сконденсировать, и полученный конденсат подвергнуть в свою очередь дистилляции, то он будет кипеть при температуре Т3 и его пар состава N5 будет еще более богат компонентом В. Продолжая такой процесс конденсации и дистилляции, можно достигнуть того, что выделяющийся пар будет представлять собой практически чистый компонент В.
Таким образом, в системе этого типа любую двойную смесь можно разделить путем дистилляции на чистые компоненты. Простая перегонка применяется, когда не требуется тщательного разделения смеси, и когда составляющие ее компоненты сильно отличаются по температурам кипения.
Если в системе имеется экстремум (азеотропная точка), то разделить систему на 2 чистых компонента А и В не удастся.
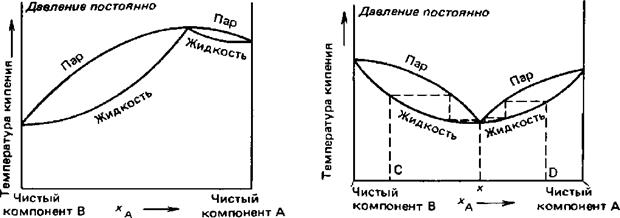
На рисунке представлены диаграммы летучей смеси с максимумом и минимумом на кривой температуры кипения. В результате фракционной перегонки в любом случае для точек, лежащих между компонентом В и азеотропной смесью (т.С) можно выделить практически чистый компонент В: для первой диаграммы он будет преимущественно содержаться в конденсате, для второй – в остатке после отгонки пара. Компонент А выделить рассматриваемым методом нельзя, только азеотропную смесь.
Для точек, лежащих между чистым компонентом А и азеотропом (т.Д), можно выделить практически чистый компонент А: для первой диаграммы он будет содержаться в парах (конденсатах), для второй – в остатке после перегонки. Компонент В из таких смесей путем перегонки выделить нельзя.
Дата добавления: 2016-12-09; просмотров: 5922;











