Энтальпия образования химических соединений
Для расчетов тепловых эффектов используют величину, называемую энтальпией.
Энтальпией (теплотой) образования химического соединения ∆ HT называется изменение энтальпии в процессе получения 1 моля этого соединения из простых веществ (элементов) при постоянном давлении.
Так, например, энтальпией образования этилового спирта C2H5OH называется изменение энтальпии при реакции углерода, кислорода и водорода при постоянном давлении
2C + 3H2 + 1/2 O2→ CH3 - CH2 - OH
И наоборот, реакции
CH2 = CH2+H2O→CH3 - CH2 - OH
CH3 - CHO+H2→CH3 - CH2 – OH
не являются реакциями ”образования” спирта, хотя и приводят к синтезу этилового спирта.
Важным термодинамическим представлением является понятие о стандартном состоянии вещества, под которым понимается его реальное состояние при 298 К и атмосферном давлении (или p = 101 кПа).
Стандартной энтальпией (теплотой) образования химического соединения 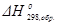 называется изменение энтальпии в процессе образования 1 моля этого соединения, находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартных состояниях и термодинамически устойчивых при данной температуре фазах и модификациях.
называется изменение энтальпии в процессе образования 1 моля этого соединения, находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартных состояниях и термодинамически устойчивых при данной температуре фазах и модификациях.
Стандартные энтальпии образования простых веществ принимают равными нулю, если их агрегатные состояния и модификации устойчивы при стандартных условиях.
Стандартная энтальпия образования соединения – мера его термодинамической устойчивости, прочности, количественное выражение энергетических свойств соединения. Если стандартная энтальпия образования отрицательна, то соединение более устойчиво, чем элементы, из которых оно состоит, или наоборот, если она положительна, то соединение менее устойчиво. Из различных молекул более устойчивы те, энтальпии, образования которых меньше.
Например, этан (∆ H298 = - 24,82 ккал/моль) более устойчив, чем этилен 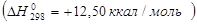
Термохимические расчеты. Значения энтальпий образования позволяет определить изменения энтальпии, сопровождающие реакции, не прибегая к прямым измерениям.
В основе большинства термохимических расчетов лежит следствие из закона Гесса:
Тепловой эффект химической реакции равен сумме теплот (энтальпий) образования продуктов реакции за вычетом суммы теплот (энтальпий) образования исходных веществ.
Так, для уравнения вида
aA + bB +…= dD + eE +…
Тепловой эффект ∆ H определяется равенством
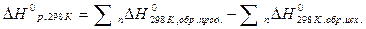 =
=
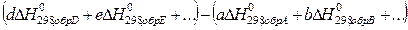
При этом следует иметь в виду, что при алгебраическом суммировании следует учитывать стехиометрические коэффициенты в уравнении реакции (а, в, d, e).
Приведенное уравнение позволяет определять как тепловой эффект реакции по известным энтальпиям образования веществ, участвующих в реакции, так и одну из энтальпий образования, если известны тепловой эффект реакции и все остальные энтальпии образования.
В настоящее время энтальпии образования известны примерно для четырех тысяч веществ, и это позволяет расчётным путем установить тепловые эффекты самых разнообразных реакций.
Пример 1. Расчет теплового эффекта реакции по стандартным энтальпиям образования веществ.
Al2O3 (к) +3SO3 (г) = Al2(SO4)3 (к)
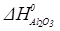 =-1675 кДж/моль;
=-1675 кДж/моль; 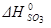 =-395, 2 кДж/моль
=-395, 2 кДж/моль
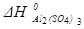 =-3434 кДж/моль
=-3434 кДж/моль
Тепловой эффект реакции 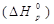 определяется по уравнению:
определяется по уравнению:
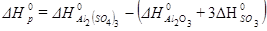
После подстановки значений стандартных энтальпий
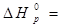 -3434-(-1675-3.395, 2)=-599 кДж/моль
-3434-(-1675-3.395, 2)=-599 кДж/моль
Видно, что 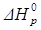 < 0, т.е. это реакция экзотермическая.
< 0, т.е. это реакция экзотермическая.
Пример 2. Расчет энтальпии образования химического соединения по известному тепловому эффекту реакции.
Определить 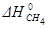 в реакции:
в реакции:
CH4 (г) + 2 H2O (г) = CO2 (г) + 4 H2 (г)
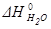 =-241,82 кДж/моль;
=-241,82 кДж/моль; 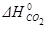 =-393,51 кДж/моль;
=-393,51 кДж/моль; 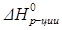 = +164,98 кДж
= +164,98 кДж
Стандартный тепловой эффект реакции равен:
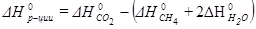 , откуда
, откуда
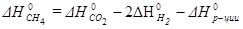
После подстановки стандартных энтальпий образования веществ:
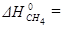 (-1 моль∙ 393,51 кДж/моль + 2 моль ∙ - 241,82 кДж/моль – 164,98 кДж) / 1 моль = - 74,85 кДж/моль
(-1 моль∙ 393,51 кДж/моль + 2 моль ∙ - 241,82 кДж/моль – 164,98 кДж) / 1 моль = - 74,85 кДж/моль
Видно, что реакция образования метана является экзотермической.
Пример 3. Расчет теплового эффекта реакции, который экспериментально определить невозможно.
Реакция 1) C + O2 = CO2, 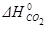 = -396 кДж/моль
= -396 кДж/моль
может быть также осуществлена в две стадии
2) C + 1/2 O2 = CO, 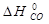 = -110, 5 кДж/моль
= -110, 5 кДж/моль
3) CO + 1/2 O2 = CO2
Тепловой эффект реакции 2) можно провести экспериментально и определить 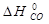 = -110, 5 кДж/моль.
= -110, 5 кДж/моль.
А вот тепловой эффект реакции 3) экспериментально осуществить и определить невозможно, поэтому 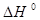 реакции 3) получают расчетным путем, используя закон Гесса
реакции 3) получают расчетным путем, используя закон Гесса
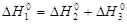
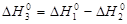
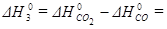 - 396 - (-110, 5) = - 285,5 кДж/моль
- 396 - (-110, 5) = - 285,5 кДж/моль
С помощью термохимических расчетов можно определить энергию химических связей, энергии кристаллических решеток, теплоты растворения и гидратации, тепловые эффекты фазовых превращений и т.д.
Энтальпия есть возрастающая функция температуры, непрерывная во всей области изменения последней, когда существует данная фаза. Для расчета теплового эффекта при температурах, более высоких, чем стандартные, используют уравнение Кирхгофа:
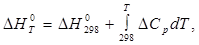
где 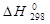 - стандартный тепловой эффект реакции при T = 298 К;
- стандартный тепловой эффект реакции при T = 298 К;
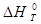 - стандартный тепловой эффект реакции при T.
- стандартный тепловой эффект реакции при T.
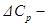 разность молярных изобарных теплоемкостей всех продуктов реакции и молярных изобарных теплоемкостей всех исходных веществ, т.е.
разность молярных изобарных теплоемкостей всех продуктов реакции и молярных изобарных теплоемкостей всех исходных веществ, т.е.
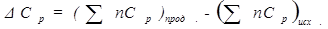
Расчеты по уравнению Кирхгофа показывают, что в том интервале температур, который может иметь практическое значение, изменение величины теплового эффекта реакции невелико.
Так, например, тепловой эффект процесса 1/2 N2 + 1/2 O2 = NO (г) при повышении температуры от 298 до 4000 К изменяется всего лишь на 2,0 кДж/моль. Еще меньше влияние давления на тепловой эффект реакции. Так, для реакции синтеза аммиака из азота и водорода различие между величинами 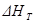 при p = 101 кПа и p = 50 МПа не превышает 5 %.
при p = 101 кПа и p = 50 МПа не превышает 5 %.
Дата добавления: 2016-12-09; просмотров: 8068;











