Химическая кинетика
Химическая кинетика – это учение о скорости химических реакций, их механизме и закономерностях протекания во времени. Для определения скорости химической реакции надо знать не только начальное и конечное состояние системы, но и путь по которому протекает реакция, поэтому получить кинетические закономерности намного сложнее, чем термодинамические.
Скорость химической реакции показывает число химических взаимодействий, приводящих к образованию продуктов реакции в единицу времени в единице объема (для жидкой среды) или на единице поверхности, если процесс идет с участием твердого вещества. Отношение изменения концентрации реагирующих веществ к конечному (измеренному) промежутку времени называют средней скоростью.
Vср = ± ∆С / ∆t = ± (Cконечное/Сначальное) / (tконечное/tначальное), моль/(л∙c)
Если Cконечное меньше, чем Сначальное, то в выражении используют знак «-», если больше, то «+».
Истинная скорость - отношение изменения концентрации реагирующих веществ к бесконечно малому промежутку времени.
Vист = ± dС / dt, моль/(л∙c) – в системе СИ.
Влияние концентрации на скорость химической реакции определяется законом действующих масс – при постоянной температуре скорость данной реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях равных их стехиометрических коэффициентов.
aA + bB ↔ cC + dD
Vпр = Кпр ∙ [A]a ∙ [B]b
Vобр = Кобр ∙ [С]с ∙ [D]d
К – константа скорости реакции показывает число эффективных соударений (тех, что привели к реакции) в расчете на 1 моль реагирующих веществ. К зависит от температуры и природы вещества, но не зависит от концентрации.
В момент равновесия скорости прямой и обратной реакции равны.
Кпр ∙ [A]a ∙ [B]b = Кобр ∙ [С]с ∙ [D]d
Кпр / Кобр = ([С]с∙[D]d) / ([A]a∙[B]b) = Кс – константа равновесия
Возьмем конкретную реакцию: N2 + 3H2 = 2NH3, тогда Кс = [NH3]2 / [N2][ H2]3.
В уравнении закона действующих масс самой трудной для определения величиной является константа скорости. Для ее определения надо знать следующие понятия: порядок реакции и молекулярность.
Молекулярность определяется числом молекул, одновременным взаимодействием которых в момент столкновения осуществляется химическое превращение.
1. Мономолекулярная: J2 = 2J.
2. Бимолекулярная: 2NO = N2O2.
3. Тримолекулярная: Cl2 + 2NO = 2NOCl
Показатель степени называется порядком по данному компоненту или частный порядок. Сумма частных порядков по всем компонентам – общий порядок.
Молекулярность и порядок совпадают только в одностадийных процессах. Они не совпадают, когда одно из реагирующих веществ взято в избытке и поэтому не участвует в определении порядка. Например:
СН3СООС2Н5 + Н2Оизбыток ↔ СН3СООН + С2Н5ОН, Vпр = Кпр ∙ [СН3СООС2Н5] ∙ [Н2О], бимолекулярная реакция первого порядка.
Если реакция проходит в несколько стадий, то порядок определяется по самой медленной – лимитирующей стадии.
Зная порядок реакции можно рассчитать константу скорости:
1. Для реакций первого порядка (разложение лекарственных средств).
Кпр = 1/t ∙ ln(Co(х)/C(х))
t – время реакции, с.
Со(х) – начальная концентрация, моль/л.
С(х) – концентрация в момент t, моль/л.
2. Для реакций второго порядка.
Кпр = 1/t ∙ (1/C(х) – 1/Co(х))
Влияние температуры на скорость химической реакции.
Это влияние определяется правилом Вант-Гоффа: при повышении температуры на 100С скорость гомогенной химической реакции увеличивается в 2 ÷ 4 раза.
V(t2) = V(t1) ∙ γ(∆t/10)
V(t2) и V(t1) – скорости реакции при температуре t2 и t1.
γ – температурный коэффициент = 2 ÷ 4, показывает во сколько раз увеличилась скорость реакции при увеличении температуры на 100С.
∆t = t2 – t1.
Для биохимических реакций температурный коэффициент при увеличении температуры на 100С получить нельзя, а только на 50С, и γ = 1,1 ÷ 1,8 раз.
Правило Вант-Гоффа работает при температуре от 00С до 1000С. Для более высоких температур используют правило Аррениуса. Аррениус предположил, что не всякое столкновение молекул ведет к химическому взаимодействию. В реакцию вступает только небольшая часть от общего количества молекул, обладающих необходимым или большим запасом энергии для протекания реакции.
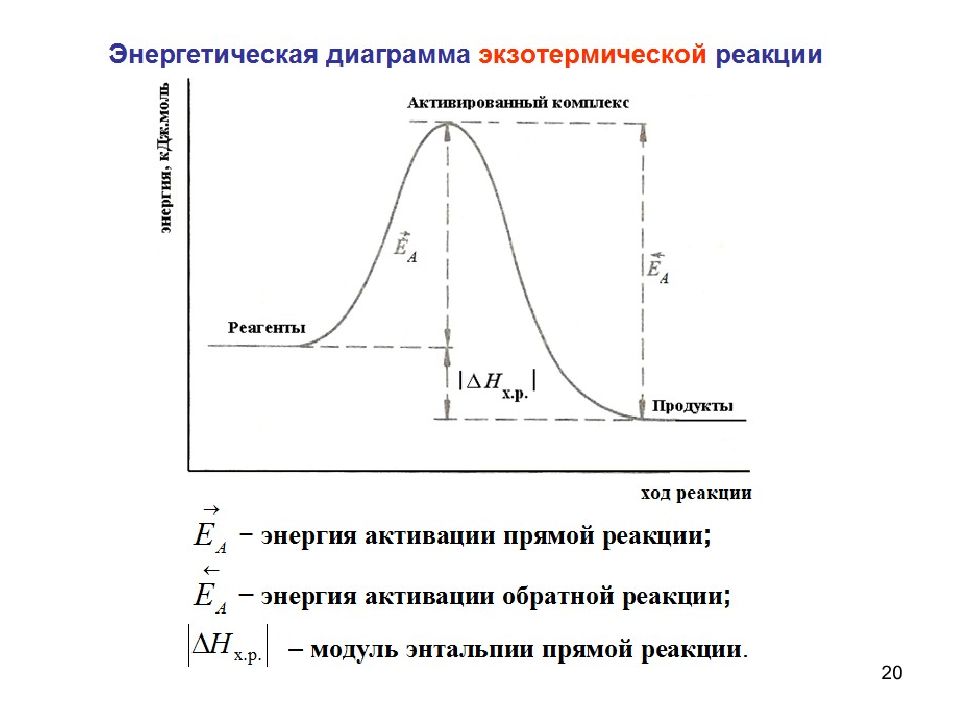
Энергия активации – Ea – избыточное количество энергии по сравнению со средней величиной, которой должна обладать молекула в момент столкновения, что бы быть способной к химическому взаимодействию. Чем меньше энергия активации, тем выше скорость реакции.
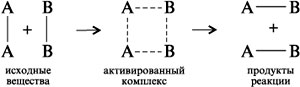
Рис.: энергия активации.
Энергия активации затрачивается на ослабление связей между атомами в молекулах реагирующих веществ. При этом вещества переходят в неустойчивое промежуточное состояние, называемое активированным комплексом.
Уравнение Аррениуса для расчета энергии активации:
(dlnK / dT) = (Ea /RT2)
Ea = (RT1T2 / (T2-T1)) ∙ ln(KT2/KT1)
где KT2 и KT1 – константы равновесия при температуре T2 и T1, соответственно.
Высокое значение энергии активации реакции нежелательно, так как это означает, что на пути к ее осуществлению стоит высокий энергетический барьер. Для большей части биохимических реакций Еа ниже в 2 ÷ 3 раза, чем для химических, так как они протекают в присутствии ферментов, которые понижают Еа. Тем не менее, энергия активации разрушения биологических структур очень высокая, что способствует защите клеток от повреждений. Скорость реакции можно увеличить путем снижения энергии активации, которое осуществляется за счет введения в реакционную среду катализатора.
Дата добавления: 2021-02-19; просмотров: 183;










