Методика составления уравнений реакций окисления – восстановления
I. Составление уравнений простейших реакций.
При составлении уравнений ОВР необходимо определить восстановитель и окислитель, а также число отдаваемых и принимаемых ими электронов. Для этого необходимо знать окислительно-восстановительную характеристику реагентов: величины потенциалов ионизации сродства к электрону и элетроотрицательности. Число электронов, отдаваемых восстановителем и принимаемых окислителем, определяется степенью окисления атомов и ионов до и после реакции.
Коэффициенты в уравнениях для восстановителя и окислителя должны подбираться с таким расчетом, чтобы общее число электронов, отданных восстановителем, равнялось общему числу электронов, принятых окислителем.
В качестве примера рассмотрим реакцию окисления алюминия кислородом.
Al + O2 =
Определяем, что является восстановителем и окислителем. Алюминий – элемент главной подгруппы III группы периодической системы, активный металл. Следовательно, алюминий будет в реакции проявлять только восстановительный свойства, его атом отдает 3 электрона.
Кислород находится в главной подгруппе VI группы, очень активный неметалл, является сильнейшим окислителем. Молекула О2 принимает 4 электрона.
Составляем вспомогательные уравнения, выражающие процессы отдачи и присоединения электронов и находим коэффициенты при восстановителе и окислителе.

| восстановитель, процесс окисления | |

| окислитель, процесс восстановления |
Числа 3 и 4 в электронных уравнениях справа от вертикальной черты и являются коэффициентами в уравнении реакции.
Уравнение в окончательном виде:
4Al + 3O2 = 2Al2O3
Правильность написания уравнения проверяем путем подсчета атомов каждого элемента в левой и правой частях уравнения.
II. Составление уравнений сложных реакций.
На скорость и направление ОВР влияет ряд факторов: природа реагирующих веществ, характер среды, концентрация реагентов, температура, катализатор. Реакционная способность молекул зависит от их химического строения и условий взаимодействия.
Влияние среды на химический процесс велико и в некоторых случаях она изменяет даже направление процесса.
Для создания в растворе кислой среды обычно пользуются серной кислотой. Соляная и азотные кислоты применяются реже, так как первая способна окисляться, а вторая сама является сильным окислителем и потому может вызывать побочные процессы.
Для создания щелочной среды применяется гидродсид натрия или гидроксид калия.
При составлении уравнений реакций с участием среды необходимо руководствоваться следующими правилами:
1. Если образующиеся вещества содержат больше кислорода, чем исходные соединения, то недостающее количество кислорода пополняется в кислых и нейтральных растворах за счет воды, а в щелочных растворах – за счет ионов ОН.
2. Если образующиеся вещества содержат меньше кислорода, чем исходные, то освобождающийся кислород в кислой среде реагирует с ионами водорода Н+ с образованием очень слабо диссоциированных молекул воды, а в нейтральной и щелочной среде – с образованием гидроксид – ионов.
3. В кислой или нейтральной среде ионы металлов (одно-, двух- и трехзарядные) взаимодействуют с кислотными остатками и образуют соли.
4. Ионы металлов, дающие нерастворимые в воде гидроксиды, в щелочной среде образуют соответствующие гидроксиды.
5. Ионы металлов (двух-, трех- и четырехзарядные), способные давать амфотерные гидроксиды, образуют в щелочной среде гидроксосоли.
Рассмотрим составление уравнения реакции сульфита натрия с перманганатом калия в зависимости от характера среды.
В кислой среде
Na2SO3 + KMnO4 + H2SO4 →
Определим восстановитель, окислитель, их степени окисления, а также необходимые коэффициенты. Руководствуясь окислительно-восстановительными свойствами реагентов, устанавливаем, что в молекуле сульфита натрия, диссоцииирующей в растворе 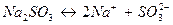 , ион SO
, ион SO  является восстановителем – в нем сера в степени окисления (+4) отдает 2 электрона и повышает степень окисления до (+6) с образованием иона SO
является восстановителем – в нем сера в степени окисления (+4) отдает 2 электрона и повышает степень окисления до (+6) с образованием иона SO 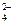 ; в молекуле
; в молекуле  анион
анион  является окислителем – в нем марганец в степени окисления (+7) принимает 5 электронов и понижает степень окисления до (+2), превращаясь в катион
является окислителем – в нем марганец в степени окисления (+7) принимает 5 электронов и понижает степень окисления до (+2), превращаясь в катион  .
.
Коэффициенты для восстановителя и окислителя находим, пользуясь схемой электронного баланса.

| восстановитель, процесс окисления | |

| окислитель, процесс восстановления |
Напишем в правой части уравнения формулы образующихся соединений.

По числу кислотных остатков в правой части уравнения находим коэффициент для кислоты. В результате реакции получается 8 кислотных остатков  , из них 5 – за счет окислительно-восстановительного процесса (превращение
, из них 5 – за счет окислительно-восстановительного процесса (превращение 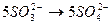 ), а 3 – за счет молекул серной кислоты (
), а 3 – за счет молекул серной кислоты (  ). По числу ионов водорода (6H+) в левой части уравнения находим коэффициент для воды.
). По числу ионов водорода (6H+) в левой части уравнения находим коэффициент для воды.
Уравнение примет окончательный вид:

Признаком правильности подбора коэффициентов является одинаковое количество атомов каждого элемента в обеих частях уравнения.
При составлении реакций можно использовать и электронно-ионный метод, в которых сильные электролиты записывают в виде ионов, а слабые электролиты, газы и осадки в виде молекул.
В ионную схему реакции включают те частицы, которые проявляют восстановительные или окислительные свойства, а также частицы, характеризующие среду: кислую – ион Н+, щелочную – ион ОН−, нейтральную – молекула Н2О.
Пример взаимодействия KMnO4 с Na2SO3 в кислой среде.
Электронно-ионные уравнения составляются отдельно для процесса восстановления и процесса окисления.


Общее число электронов, отдаваемых восстановителем, должно быть равно числу электронов, присоединяемых окислителем – находим коэффициенты для окислителя и восстановителя:

| |

|
Суммируем электронно-ионные уравнения (предварительно умноженные на коэффициенты).

Сократив подобные члены, находим ионное уравнение:
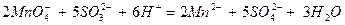
Это уравнение в молекулярной форме имеет вид:
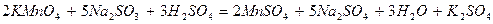
В щелочной среде
В сильно щелочной среде при недостатке восстановителя перманганат калия восстанавливается сульфитом натрия в манганат калия (красно-фиолетовая окраска раствора переходи в зеленую).

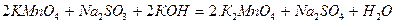
Дата добавления: 2016-11-04; просмотров: 2416;










