Лабораторной практике
Кислород (O2) – применяется для интенсификации производственных процессов в металлургической и химической промышленности; используется в смеси с ацетиленом для получения высоких температур (3500°С) при сварке и резке металлов; широко применяется в медицине, вдыхание 40-60% смеси кислорода с воздухом ускоряет процессы окисления в организме, уменьшая нагрузку на сердце и легкие. Кислород является сильным окислителем, особенно при нагревании. Атомарный кислород значительно активнее молекулярного. Восстановительные свойства кислород проявляет лишь по отношению к фтору.
2NaOH + 2F2 = OF2 + 2NaF + H2O
Озон (O3) – более сильный окислитель, чем кислород. Он обесцвечивает многие красящие вещества, окисляет металлы (за исключением золота, платины), аммиак в азотистую и азотную кислоты, сульфиды в сульфаты. Озон убивает бактерии, поэтому применяется для обеззараживания воды и для дезинфекции воздуха. Озон легко разлагается с выделением атомарного кислорода.
O3 = O2 + O
Озон легко окисляет серебро.
Ag + O3 = AgO + O2
Перманганат калия (KMnO4) – очень сильный окислитель, применяется для окисления многих органических соединений. Окисляет сульфиты в сульфаты, нитриты в нитраты, йодистый калий до свободного йода, соляную кислоту до хлора, перекись водорода до кислорода. Характер восстановления KMnO4 зависит от среды, в которой протекает реакция:
в кислой среде (рН < 7)
KMnO4 ↔ K+ + MnO 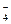
MnO 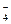 → Mn2+
→ Mn2+
фиолетово- слабо-розовая
малиновая или бесцветная
окраска окраска
в нейтральной или слабощелочной среде (рН ≥ 7)
MnO 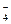 → MnО2↓
→ MnО2↓
фиолетово- бурый
малиновая
окраска
в сильнощелочной среде (рН >> 7)
MnO 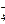 → MnO
→ MnO 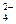
фиолетово- зеленая
малиновая окраска
окраска
Хромовая и двухромовая кислоты – используются соли этих кислот: хромат калия K2CrO4 и бихромат калия K2Cr2O7
CrO 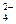 ; Cr2О
; Cr2О 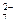
желтая оранжевая
окраска окраска
Все соли хромовых кислот, а также ангидрид хромовой кислоты (CrO3) в кислой среде являются сильными окислителями:


Азотная кислота (HNO3) – сильнейший окислитель. Азот в составе аниона NO 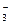 может в зависимости от условий (концентрации кислоты, природы восстановителя, температуры) принимать от 1 до 8 электронов:
может в зависимости от условий (концентрации кислоты, природы восстановителя, температуры) принимать от 1 до 8 электронов:

При восстановлении азотной кислоты практически не выделяется газообразный водород.


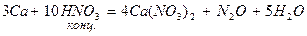


Большинство неметаллов восстанавливают азотную кислоту до оксида азота (II).
Азотная кислота широко применяется в производстве химико-фармацевтических препаратов (стрептоцид), органических красителей, целлулоида, кино- и фотопленки. В клинических методах исследования мочи используется 1% раствор азотной кислоты.
Азотная кислота (HNO3) – является окислителем, но при взаимодействии с более сильными окислителями сама проявляет восстановительные свойства, окисляясь до азотной кислоты. Азотистая кислота и ее соли (KNO2, NaNO2) применяются в производстве органических красителей.
Серная кислота (H2SO4 концентрированная) сильный окислитель, особенно при высокой температуре: окисляет
| С → СО2 S → SO2 HJ → J2 | Cu → Cu+2 Ag → Ag+ Hg → Hg+2 |
При взаимодействии мало активных металлов и металлов средней активности с концентрированной H2SO4 продуктом восстановления является SO2.
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
Серная кислота концентрацией выше 93% не действует на железо (пассивирует).
В случае сильных восстановителей (щелочных и щелочно-земельных металлов) продуктом восстановления будет H2S.
4Mg + 5H2SO4 = H2S + 4MgSO4 + 4H2O
Серная кислота применяется при синтезе лекарственных веществ, в металлургии, производстве красителей.
Перекись водорода (H2O2) применяется для отбеливания тканей, слоновой кости, соломы, мехов. Сильно разбавленная перекись применяется в медицине для дезинфекции ран. Перекись водорода может проявлять как окислительные:
2KJ + H2O2 + H2SO4 = J2 + K2SO4 + 2H2O
так и восстановительные свойства:
5 H2O2 + 2KMnO4 + 3H2SO4 = 5O2 + MnSO4 + K2SO4 + 8H2O
а также способна к реакциям дисмутации (диспропорционирования)
H2O2 + H2O2 = O2 + 2H2O
Дата добавления: 2016-11-04; просмотров: 713;










