Лабораторной практике
Железо (Fe), цинк (Zn), алюминий (Al) и олово (Sn) применяются в качестве восстановителей в производстве органических соединений (восстановление нитросоединений).
Углерод (С) – применяется для восстановления металлов из оксидов.
С + ZnO = Zn + CO
Окись углерода (СО) – играет важную роль в металлургии при восстановлении металлов из их оксидов.
CO + 3Fe2O3 = 2Fe3O4 + CO2
CO + Fe3O4 = 3FeO + CO2
FeO + CO = Fe + CO2
Водород так же проявляет восстановительные свойства – водородотермия.
CO + H2 = C + H2J
CuO + H2 = Cu + H2O
CO +2H2 = CH3OH
Сернистая кислота используется в качестве восстановителя для получения в свободном виде неорганических веществ, восстановления их ионов и других органических соединений.
Сернистая кислота в водном растворе диссоциирует по схеме:
H2SO3 ↔ H+ + HSO 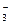 ↔ H+ + SO
↔ H+ + SO 
Ион SO  , проявляя восстановительные свойства, отдает 2
, проявляя восстановительные свойства, отдает 2 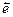 и превращается в ион SO
и превращается в ион SO 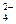 как в кислой, так и в нейтральной средах.
как в кислой, так и в нейтральной средах.
Сульфит (Na2SO3) и гидросульфит натрия (NaHSO3) применяется для восстановления в фотографии (Na2SO3) и в текстильной промышленности (NaHSO3) для уничтожения следов хлора в отбеленных тканях.
NaHSO3 + Cl2 + H2O = NaHSO4 + 2HCl
Сульфид натрия (Na2S) используется для восстановления ароматических нитро- и азосоединений. Сульфид-ион окисляется до элементарной серы S0 или до сульфат-иона SO 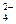 в зависимости от силы окислителя, его концентрации и температуры. При реакциях обжига ион S
в зависимости от силы окислителя, его концентрации и температуры. При реакциях обжига ион S 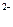 окисляется до
окисляется до  .
.
Тиосульфат натрия (Na2S2O3) применяется в качестве восстановителя в красильном деле с целью освобождения отбеливаемого материала от избытка хлорноватистой кислоты.
Na2S2O3 + 4HClO + H2O = 2H2SO4 + 2NaCl + 2HCl
Металлический натрий (Na) как восстановитель может быть использован для получения в свободном виде элементов подгруппы титана.
4Na + ЭCl4 = Э + 4NaCl
Водород (Н) – атомарный водород значительно более активен, чем молекулярный и при обычных условиях взаимодействует с серой, мышьяком; восстанавливает многие металлы из их оксидов и солей.
Водородотермия широко применяется в промышленности для получения чистого вольфрама, молибдена, германия, кобальта.
2H2 + GeO2 = Ge + 2H2O
H2 + CoO = Co + H2O
Электрический ток – под его действием протекает электролиз, сопровождающийся восстановлением катиона на катоде и окислением аниона на аноде. При электролизе раствора хлористого никеля протекают процессы:
| на катоде | на аноде |
Ni2+ + 2 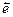 = Ni0 = Ni0
| 2Cl- − 2 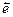 = 2Cl0 → = 2Cl0 →  2 2
|
Группа окислителей
Окислителями могут быть: нейтральные атомы и молекулы (сильными окислителями являются неметаллы – фтор, кислород, хлор); положительно заряженные ионы металлов (сильные окислители – положительно заряженные ионы с высокой степенью окисления: Fe3+, Cu2+, Sn4+); сложные ионы и молекулы, содержащие атомы металла в состоянии высшей степени окисления ( 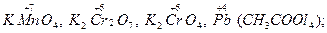 сложные ионы и молекулы, содержащие атомы неметалла в состоянии высшей положительной степени окисления (к числу этих окислителей относятся кислородные кислоты, их ангидриды и соли:
сложные ионы и молекулы, содержащие атомы неметалла в состоянии высшей положительной степени окисления (к числу этих окислителей относятся кислородные кислоты, их ангидриды и соли:  ).
).
Дата добавления: 2016-11-04; просмотров: 957;










