Другие факторы, влияющие на упругость насыщения
Кривизна испаряющей поверхности. Давление насыщенного пара зависит не только от температуры и фазового состояния испаряющей среды, но и от кривизны испаряющей поверхности. При одинаковой температуре и фазовом состоянии испаряющей среды давление насыщенного пара над выпуклой поверхностью больше, чем над плоской, а над плоской больше, чем над вогнутой. Однако эти различия заметны только над капельками радиусом менее 10-4 см и над капиллярами такого же малого радиуса, имеющимися в почве, в ядрах конденсации и других частицах. Причина этого явления заключается в том, что на отдельную молекулу, расположенную на поверхности жидкости, действуют силы притяжения со стороны всех других молекул, находящихся внутри сферы молекулярного действия (рис.2.1). Это т.н. силы поверхностного натяжения.
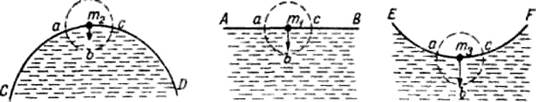
Рис. 2.1. Силы молекулярного взаимодействия на выпуклой,
плоской и вогнутой поверхностях жидкости
Вертикальной стрелкой показана равнодействующая всех молекулярных сил, действующих на молекулу в объеме abca.
На выпуклой поверхности в сферу молекулярного действия входят молекулы воды в объеме abca, которые удерживают молекулу m2внутри жидкости.
На плоской поверхности число молекул в объеме abca больше, чем на выпуклой, поэтому равнодействующая всех сил, удерживающая молекулу m1 внутри жидкости, больше, чем на выпуклой поверхности. На вогнутой поверхности число молекул в объеме abca еще больше, чем на плоской. Соответственно больше и равнодействующая сил, препятствующих отрыву молекулы m3 от поверхности. Поэтому молекулам, стремящимся оторваться от выпуклой поверхности, требуется на преодоление сил сцепления меньше энергии, чем молекулам, отрывающимся от плоской поверхности. Молекулы, отрывающиеся от вогнутой поверхности, должны затратить на преодоление сил сцепления больше энергии, чем молекулы, отрывающиеся от плоской поверхности. В результате давление насыщенного пара при одинаковой температуре над выпуклой поверхностью оказывается больше, чем над плоской, а над плоской больше, чем над вогнутой, на некоторую величину ∆Е: ЕR = Е0 + ∆Е (2.2)
ER – давление насыщенного пара над выпуклой или вогнутой поверхностью; Е0 – давление насыщенного пара над плоской поверхностью, причем знак «+» соответствует выпуклой поверхности, знак «–» вогнутой. Отношение ER/E0 вычисляется с помощью формулы Томсона
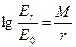 , (2.3)
, (2.3)
где M – коэффициент, зависящий от температуры (M = 0.52∙ 10-7 см при t = 0°С, M = 0.47∙ 10 -7 см при t = 20 °С); r – радиус кривизны поверхности в сантиметрах.
Отношение Er /E0 (где Е0 – давление насыщенного пара над плоской поверхностью дистиллированной воды при 0°С) в зависимости от r принимает следующие значения:
r см............................ 10-7 10-6 10 -5 10 -4
Er / E0......................... 3.320 1.128 1.012 1.0012.
Насыщение пара над поверхностью капель достигается только при определенном пересыщении относительно плоской поверхности воды. Из приведенных данных видно, что с уменьшением радиуса капли пересыщение увеличивается. Чем меньше радиус капли, тем больше это пересыщение. Так, для капли радиусом 10 -7 см давление насыщенного пара составляет 332 % от Е0, а для капель радиусом 10 -4 см – только 100.1 %.
Растворы солей. Капли воды, взвешенные в атмосфере или выпадающие из облаков, всегда содержат некоторое количество растворенных солей и кислот. Давление насыщенного пара над плоской незаряженной поверхностью раствора какого-либо вещества (Ер)меньше, чем над дистиллированной водой (Ед). Объясняется это тем, что силы сцепления между молекулами растворенного вещества и растворителя (воды) превосходят силы сцепления между молекулами чистой воды. На поверхности оказывается меньше способных испаряться молекул растворителя, ведь часть места занимает растворённое вещество.

Согласно закону Рауля, парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причем коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом:
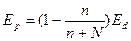 (2.4)
(2.4)
где N – число молей воды; п – число молей растворенного вещества. Отсюда
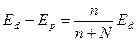 . (2.5)
. (2.5)
Разность Ед – Eр значительна только при больших концентрациях растворов. Так, над морской водой средней солености давление насыщенного пара всего на 1.95 % меньше, чем над пресной водой. Но в атмосфере иногда встречаются капли, представляющие собой насыщенный или близкий к нему раствор солей. Над такими каплями давление насыщенного пара значительно ниже, чем над поверхностью чистой воды.
Дата добавления: 2016-11-04; просмотров: 2218;










