Фосфин проявляет метаболическое сходство с фосфорорганическими веществами и фосфатами, хотя структурным аналогом их не является – еще один аргумент в пользу фосфиноксида
В обзоре [154] приводится информация об ингибировании фосфином ацетилхолинэстеразы (рис. 8). Поэтому на животных он оказывает нервно-паралитическое действие. Известно, что ацетилхолинэстераза блокируется диметиларсинатами [294], фосфорорганическими соединениями [295-300], такими как армин (О-этил, О-п-нитрофенилэтилфосфонат), применяемый в качестве эффективного препарата для лечения глаукомы, и замещенными фосфатами (например, диизопропилфторфосфатом [301], О, О-диэтил, О-п-нитрофенилфосфатом (параоксон) [302], замещенным тиофосфатом малаоксоном – метаболитом карбофоса [303]; рядом природных веществ, например, циннамоилфосфорамид и циклофостин из стрептомицетов, анатоксин из цианобактерий, улосантоин из морских губок [304-306]). Их действие объясняется структурным сходством групп P=O в составе фосфорорганических соединений, As=O в составе диметиларсиновой кислоты, с эфирной группой ацетила СН3-(С=О)-О в составе ацетилхолина. Как известно, гидролиз ацетилхолина сопровождается переносом ацетила на гидроксильную группу серина в активном центре ацетилхолинэстеразы. Ингибиторы фермента образуют прочные эфиры с указанным гидроксилом, и лишают фермент активности. Однако, фосфин не является структурным аналогом ацетилхолина. Поэтому, вполне возможно, что ингибиторами являются продукты окисления фосфина, в том числе, предполагаемые аддукты фосфиноксида.
Не только ацетилхолинэстераза ингибируется фосфорорганикой, но и ряд других ферментов, содержащих в активном центре остаток серина, например, сериновые протеазы [307], полигидроксиалканоатгидролазы бактерий [308]. В связи с этим, в статье [309] приводится интересное исследование по секвенированию и сравнению геномов жуков малых булавоусых хрущаков (Tribolium castaneum), чувствительных к действию фосфина и выработавших к нему устойчивость. Среди генов, максимально подверженных отбору в процессе возникновения устойчивости к фосфину, есть и гены сериновых протеаз! То есть, данные ферменты тоже чувствительны к фосфину.
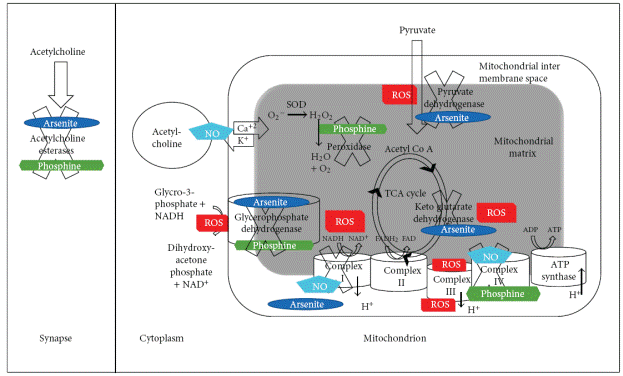
Рис. 8. Взаимодействие фосфина с ферментами, вовлеченными в процессы метаболизма и передачу сигналов ацетилхолином. Также показаны участки взаимодействия с арсенитом и оксидом азота NO: фосфин обозначен зеленым цветом, арсенит темно-синим, оксид азота голубым. Также обозначены участки образования активных форм кислорода (красный цвет). Названия ферментов, зачеркнутые крестиками означают, что фермент ингибируется. Потоки ионов калия и кальция регулируются ацетилхолином через NO. Са2+ перемещается при участии ацетилхолина из пузырьков в цитоплазму нейронального синапса. Ацетихолинэстераза разлагает ацетилхолин и тем самым ослабляет передачу нервного импульса. Действие арсенита и фосфина осуществляется за счет ингибирования эстеразы и усиления ацетилхолиновых сигналов. FAD/FADН2 (никотинамидадениндинуклеотид окисленный и восстановленный), NAD+/NADН2 (флавинадениндинуклеотид окисленный и восстановленный), ADP/ATP (аденозинди/трифосфат), NO (оксид азота), ROS (активные формы кислорода), TCA (цикл трикарбоновых кислот). По [154].
Авторы [310] сообщают интересный факт о влиянии фосфина на метаболизм фосфата у морских организмов. Фосфин, выделяющийся морскими донными осадками, в низких концентрациях активирует, а в более высоких, наоборот, угнетает активность щелочной фосфатазы и экспрессию гена белка транспортера фосфата у планктонной диатомой водоросли Thalassiosira pseudonana. В данном случае механизм воздействия фосфина также неизвестен. Таким образом, фосфин подавляет активность разнообразных белков, вовлеченных в метаболизм фосфата. Если здесь имеет место конкурентное ингибирование, то его могут осуществлять продукты окисления фосфина, в том числе аддукты фосфиноксида, имеющие структурное сходство с фосфатом. Косвенным подтверждением этого предположения является действие ряда фосфорорганических антибиотиков (например, продуцируемой некоторыми Streptomyces [(2R, 3S)3-метилоксиран-2-ил]фосфоновой кислоты, известной как фосфомицин), основанное на структурном сходстве с фосфоенолпировиноградной кислотой – ключевым интермедиатом метаболизма у широчайшего круга организмов, от бактерий до млекопитающих и высших растений [311, 312]. У бактерий фосфоенолпируват (ФЕП) играет важную роль в формировании клеточной стенки: именно фермент, осуществляющий реакцию этерификации УДФ-N-ацетиглюкозамина с участием ФЕП, необратимо блокируется фосфомицином [312]. Парадокс в том, что токсичность фосфомицина и ряда подобных ему антибиотиков определяется как раз необходимостью фосфора для всех живых организмов [313]! Налицо единство противоположностей.
Исследования метаболизма в организме (T. castaneum) фосфина, меченого радиоактивным изотопом 32Р [314, 315], показали, что радиоактивная метка распределяется в большинстве фракций биологических молекул (сахара, аминокислоты, белки, органические кислоты), однако для авторов [314] стало неожиданным отсутствие метки в липидной фракции. Сами авторы объясняют это интенсивным окислением липидов в результате индуцированного фосфином окислительного стресса, и переходом метки из липидной фракции в фосфорную кислоту, которая в липидах нерастворима. Включение радиоактивной метки в фракции биологических молекул также можно объяснить образованием аддуктов с фосфиноксидом: к сожалению, авторы не стали изучать химическую природу метки, ограничившись только ее обнаружением.
Дата добавления: 2019-09-30; просмотров: 294;










