Фосфин – источник фосфиноксида: его нахождение в природе
Если в химии существование фосфиноксида (рис. 2) уже доказано, и даже известен ряд его свойств, то в биологии и медицине он до сих пор остается гипотетической молекулой: в живых организмах он не обнаружен. Тем не менее, в литературных источниках звучит предположение, что именно фосфиноксид определяет токсичность фосфина – известного фумиганта и неизменного компонента болотного газа. А обнаружить его в живых тканях не позволяет чрезвычайная химическая активность – фосфиноксид вступает в реакции фактически в момент своего образования.
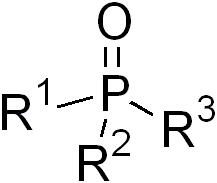
Рис. 2. Общая формула фосфиноксидов (изображение с сайта https://en.wikipedia.org )
С незапамятных времен известно явление, получившее название «болотные огни» – самовозгорание насыщенного метаном болотного газа, образующегося в результате жизнедеятельности анаэробной микрофлоры донных иловых отложений.
Причиной самовозгорания болотного газа (свалочного газа, биогаза) является примесь летучих соединений фосфора – фосфина, метилфосфина и дифосфина, образующихся в результате анаэробного фосфатного дыхания – биохимического восстановления ортофосфата (фосфор в степени окисления +5) до фосфина (фосфор в степени окисления –3) [130-139] (рис. 3). Стандартный окислительно-восстановительный потенциал Е0´ системы переноса электрона фосфорная кислота/фосфин чрезвычайно низок и составляет -680 мВ при рН 7. Для сравнения, значение того же показателя для системы углекислый газ/метан при биологическом метаногенезе составляет -244 мВ, а для углекислый газ/угарный газ -520 мВ. Тем не менее, даже метановое брожение дает очень незначительный выход энергии, что обусловливает медленный рост и крайнюю специализацию метаногенных архей, занявших неблагоприятную экологическую нишу [140].
Поскольку Е0´ окисления органических веществ имеет -434 мВ, то даже в строго анаэробных условиях фосфорная кислота не может восстанавливаться до фосфина в одну стадию [141]. Путь последовательных реакций восстановления представлен на рис. 2. Окислительно-восстановительные потенциалы восстановления фосфата до фосфина через фосфит и элементный фосфор составляют -510, -1020 и -456 мВ, соответственно [141]. Низкая, фактически, следовая концентрация выделяющегося фосфина (в донных осадках и фекалиях фосфин обнаруживается в наномолярных концентрациях) объясняется как раз энергетической затрудненностью такого восстановления. Соответственно, и энергетический выигрыш от фосфатного дыхания крайне низок. Вполне возможно, что оно представляет собой побочное следствие других анаэробных путей метаболизма. Следует, тем не менее, помнить о том, что в анаэробных условиях фосфат более доступен для бактерий, чем в аэробных. Связано это с тем, что в анаэробной среде трехвалентное железо восстанавливается до двухвалентного, а соли двухвалентного железа (в том числе и фосфаты) намного лучше растворимы в воде [142]. При избыточной подкормке фосфором в виде фосфатов или фосфоноацетатов содержание фосфина в болотном газе растет [130, 131].
Тем не менее, фосфатное дыхание – не самый поразительный пример биологического восстановления. Еще удивительнее образование в строго анаэробных условиях, в гниющей биомассе морских водорослей, газа станнана SnH4 в результате восстановления соединений олова [138, 143]! Станнан является восстановителем, сравнимым с щелочными металлами, самовозгорается на воздухе и реагирует с водой, с кислородом взаимодействует со взрывом очень большой мощности, а в анаэробных условиях быстро распадается на молекулярный водород и металлическое олово (реакция оловянного зеркала), обладает экстраординарной токсичностью.
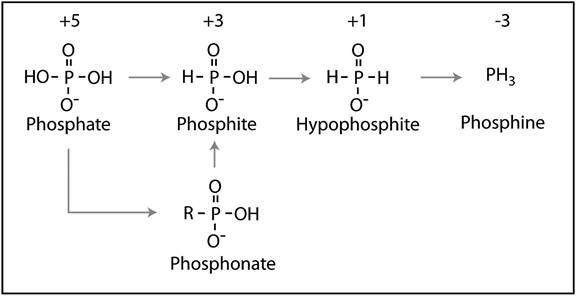
Рис. 3. Схема фосфатного дыхания по [139].
Абиогенным путем фосфин может образовываться из природных фосфидов, встречающихся исключительно редко – в упавших на Землю метеоритах. Примером их могут служить минералы шрейберзит и аллабогданит, представляющие из себя сложные фосфиды железа и никеля в разных соотношениях, и выделенные исключительно из метеоритов [144]. На нашей планете фосфиды образуются при взаимодействии мелкодисперсных металлов с белым и красным фосфором, как результат деятельности человека, и находят применение в качестве полупроводниковых материалов и как источник фосфина [145-147]. Очень сильные восстановители, такие как металлический магний, при нагреве способны восстанавливать до фосфида даже фосфат [148].
8Mg + Ca3(PO4)2 →Mg3P2 + 3CaO + 5MgO
Карбид кальция технической чистоты всегда содержит примесь фосфида кальция. Образующийся при его гидролизе фосфин придает выделяющемуся ацетилену специфический «запах карбида», а при избыточной концентрации приводит к его самовозгоранию [149].
Под давлением и при температуре 550K белый фосфор вступает в реакцию с водяным паром с образованием фосфина [150]:
2Р4 + 12Н2О → 5РН3 + 3 Н3РО4
Еще один способ получения фосфина – электрохимический, путем катодного восстановления расплава белого фосфора в кислом электролите [151].
Фосфин (фосфан) РН3, наряду с гипотетическим фосфораном РН5, является фосфористым водородом и относится к классу летучих водородных соединений. Бесцветный газ с неприятным гнилостным запахом, в 1.2 раза тяжелее воздуха. Нерастворимый в воде, но хорошо растворимый в сероуглероде и неполярных органических растворителях (бензол, диэтиловый эфир), легко впитывается в жиры, масла, пластмассы и резину, огнеопасный, сильный восстановитель. Гомологи фосфина, такие как дифосфин (дифосфан) Н2Р-РН2, еще менее устойчивы и самовозгораются на воздухе. Фосфин сжижается при -87.8 °С, при -133.8 °С замерзает в виде кристаллов с гранецентрированной кубической решеткой. При низких температурах с водой образует клатратный лед состава 8РН3·46Н2О [152]. Фосфин чрезвычайно токсичный газ (смерть может наступить при длительном вдыхании фосфина в концентрации 10 мг/м3 воздуха), применяется в сельском хозяйстве в качестве фумиганта: им протравливают хранящееся зерно [153]. Легко гидролизующиеся фосфиды, например, фосфид цинка Zn3P2, кальция Са3P2, магния Mg3P2, алюминия AlP, используется как родентициды – при поедании грызунами они образуют фосфин в желудке [154]. Согласно обзору [154], посвященному механизмам токсического действия фосфина, он является ядом, угнетающим клеточное дыхание и поражающим митохондрии. Авторы на страницах обзора высказывают предположение, что токсическое действие оказывает не фосфин, а продукт его окисления активными формами кислорода фосфиноксид (фосфаноксид), состоящий из двух таутомерных форм Н2РОН (гидроксифосфин) и Н3Р=О (оксофосфоран), и образующийся в митохондриях. Кстати, круглые черви и насекомые, выработавшие генетическую устойчивость к фосфину, характеризуются пониженной интенсивностью клеточного дыхания [154-157]. Фосфиноксид, в свою очередь, чрезвычайно нестабилен, и длительное время был известен только как короткоживущий интермедиат, но не самостоятельное вещество. Впервые получить его в весовых количествах совсем недавно удалось Д.Г. Яхварову [158, 159], и то только в виде компонента смеси. Очевидно, что причиной токсичности и мутагенных свойств фосфиноксида является его высочайшая реакционная способность. Из вышесказанного следует вывод, что в анаэробных условиях фосфин не должен проявлять токсических свойств. Этот вывод напрямую подтверждается на страницах [154], где сообщается об отсутствии токсичности фосфина для анаэробных микроорганизмов (по крайней мере, в тех концентрациях, в которых он продуцируется их сообществами).
Дата добавления: 2019-09-30; просмотров: 855;










