Фотохимические реакции
Фотохимическиминазываются реакции, протекающие под действием света, а так же невидимых лучей близких по длине волны к видимому свету.
Выделяют первичные и вторичные фотохимические процессы.
1) Первичные фотохимические процессы
Первичными называются реакции (процессы), непосредственно вызываемые действием света, к ним относятся:
· возбуждение молекул или атомов, в результате чего образуются менее устойчивые частицы способные к дальнейшим превращениям:
М + hν = М*,
hν – световой квант, а М* - возбужденная молекула.
· диссоциация молекул на атомы или радикалы (фотолиз):
АВ + hν → А + В,
· ионизация молекул и атомов с выделением электрона (фотоэффект):
М + hν → М+ + е
2) Вторичные фотохимические процессы
Вторичными называются реакции, не требующие освещения для своего протекания и называемые, поэтому темновыми.
Активные частицы, образованные в первичных реакциях, могут вызывать дальнейшее протекание следующих вторичных процессов:
- простые или разветвленные цепные реакции,
- обычные стехиометрические реакции с образованием неактивных продуктов,
- потеря энергии за счет излучения без химической реакции (например, передача энергии молекулам растворителя),
- рекомбинация, возникших при фотодиссоциации атомов и молекул, причем рекомбинация облегчается молекулами растворителя.
Сенсибилизированными называются такие реакции, в которых активные частицы могут передавать свою энергию молекуле другого вещества, а та затем вступать в химическую реакцию.
Вещества, которые сами не участвуют в фотохимической реакции, но поглощают кванты света и передают их реагентам, называются сенсибилизаторами.
Важнейшим фотохимическим процессом является фотосинтез – образование углеводов в растениях, происходящее под действием солнечного света.
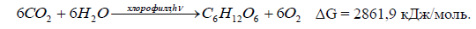
Суммарное уравнение реакции механизма не отражает. Действительный механизм фотосинтеза чрезвычайно сложен. Протекает процесс только в присутствии хлорофилла, который поглощает красные, синие и в меньшей степени зеленые лучи. Активированный таким образом хлорофилл содействует образованию из диоксида углерода и воды углеводов, необходимых для роста растений и кислорода. Хлорофилл переводит лучистую энергию в химическую, т.е. является фотосенсибилизатором.
Основные понятия катализа
Каталитические реакции чрезвычайно распространены в природе. Большинство биологических процессов катализируется и регулируется особыми веществами – ферментами. Более 90% всей продукции на химических предприятиях основаны на катализе. Это полимеризация, крекинг нефти и многие другие процессы.
Катализомназывается явление изменения скорости термодинамически возможной химической реакции под влиянием веществ, которые участвуют в реакции, но остаются в неизменном количестве и составе после ее окончания. Такие вещества называются катализаторами.Реакции, идущие с участием катализаторов, называют каталитическими.Влияние катализаторов на скорость химической реакции в основном заключается в осуществлении процесса, энергия активации которого ниже, чем энергия активации некаталитического процесса.
Катализаторами могут быть самые разнообразные вещества в любом из трех агрегатных состояний: кислоты, соли, основания, оксиды, металлы, различные органические и органоминеральные соединения, газообразные вещества. В ряде случаев каталитическое действие оказывают всевозможные примеси (например, пыль), поверхность стенок сосуда, а также продукты реакций.
Катализатором может быть и продукт данной реакции. Это явление называют автокатализом, а реакцию автокаталитической.
Катализ может быть положительный (увеличивает скорость реакции) и отрицательный (уменьшает скорость реакции - ингибирование). Вещество, в присутствии которого скорость уменьшается, называется ингибитором.
Особенности каталитических реакций следующие:
· количество катализатора и его химический состав не изменяются в ходе
реакции;
· катализатор не изменяет термодинамически возможное положение химического равновесия (следовательно, константу равновесия), он ускоряет его достижение, что возможно в случае протекания реакции по другому
более энергетически выгодному пути (меньше энергия активации);
· катализаторы ускоряют только определенный тип каталитических реакций, то есть действие катализаторов специфично;
· способность катализатора ускорять лишь одну из термодинамически возможных реакций образования конкретного целевого продукта называется селективностью катализатора;
· катализаторы чувствительны к присутствию примесей, которые могут как
усиливать действие катализатора (промотировать), так и ослаблять его (ингибировать).
В зависимости от агрегатного состояния веществ, участвующих в реакции, катализ делят на гомогенныйи гетерогенный.
-При гомогенномкатализе все взаимодействующие вещества и катализатор находятся в одной фазе. Он наиболее распространен среди реакций в жидкой фазе.
-При гетерогенномкатализе каталитическая реакция протекает на поверхности раздела фаз: т – г; т – ж; ж – г. Катализаторами в таких случаях могут быть твердые вещества (металлы, оксиды и т.д), то есть реагенты и катализатор находятся в разных контактирующих фазах.
В качестве примера можно назвать реакции окисления аммиака (газообразная фаза) в присутствии платины (твердая фаза) или разложение пероксида водорода (жидкая фаза) в присутствии угля или диоксида марганца (твердая фаза).
Процесс гетерогенного катализа можно представить как последовательность нескольких стадий:
- диффузия (подвод) реагентов к поверхности катализатора;
- адсорбция реагентов на поверхности катализатора А + В + К → АВК;
- каталитическая реакция – химическое превращение исходных молекул в продукты АВК → СДК;
- десорбция продуктов реакции с поверхности катализатора СДК →С + Д + К;
- диффузия (отвод) продуктов реакции из реакционной зоны.
При гетерогенном катализе снижается энергия активации реагирующей системы за счет энергии адсорбции и повышается концентрация реагирующего вещества (или обоих веществ) на границе раздела. В результате скорость химической реакции возрастает.
Поверхность катализатора неоднородна (впадины, выступы на поверхности). На ней имеются так называемые активные центры, на которых главным образом и протекают каталитические реакции.
Промежуточное положение занимает ультрамикрогетерогенный катализ, то есть катализ коллоидными частицами. К нему относят мицеллярный и ферментативный катализ.
Мицеллярный катализ – это ускорение химических реакций в результате увеличения концентрации реагентов в мицеллах поверхностно-активнывеществ (ПАВ) или в результате изменения степени диссоциации реагентов в присутствии мицелл ПАВ.
Ферментативный катализ обусловлен специфическим действием белковых веществ - ферментов. Данный вид катализа проявляется во множестве процессов, протекающих в живых организмах.
Каталитическая активность катализаторов определяется изменением скорости реакции в присутствии катализатора. Общим для каталитических процессов является то, что катализатор не влияет на положение термодинамического равновесия, т. е. на величину константы равновесия K = k1 / k2. Он одинаково ускоряет прямую и обратную реакцию. Катализатор уменьшает время достижения равновесия.
Поэтому можно добиться значительной скорости экзотермических обратимых реакций при невысоких температурах (такие реакции протекают тем полнее, чем ниже температура, но без катализатора недостаточно быстро).
Изменение скорости химической реакции под влиянием положительного катализатора объясняется уменьшением энергии активации, т.е. снижением потенциального барьера. При этом образуется активированный комплекс с более низким уровнем энергии и реакция существенно возрастает.
Катализаторы со временем теряют свою активность. Это происходит, если в результате побочных химических процессов каталитически активный центр блокируется, и выводится из сферы реакции. Иногда активность катализатора резко уменьшается в присутствии незначительных количеств некоторых веществ. Это явление называют отравлением катализаторов, а вещества, резко снижающих активность катализатора, каталитическими ядами.
Исходя из химической природы катализатора и реагентов, различают автокатализ; кислотно-основной катализ; окислительно-восстановительный катализ; катализ комплексами, металлами и оксидами металлов и др.
Автокатализ. В этом случае катализатором может быть один из продуктов реакции. Примеры автокаталитической реакции:
1) восстановление окиси железа водородом FeO + H2=Fe + H2O катализируется Fe.
2) омыление уксусноэтилового эфира в нейтральном растворе:
CH3COOC2H5 + H2O → CH3COOH + C2H5OH
Катализатором является уксусная кислота, точнее ионы водорода H+.
По мере взаимодействия участвует все большее количество катализатора, поэтому скорость постоянно возрастает. Для автокаталитической реакции А → В скорость образования продукта запишется в виде:
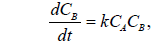
так как скорость каталитической реакции пропорциональна количеству катализатора.
Характерные особенности автокаталитической реакции:
- реакция идет при переменно возрастающей концентрации катализатора;
- автокаталитическая реакция возможна, если наряду с ней протекает некаталитическая реакция или если к начальному веществу добавить некоторое количество продукта реакции (затравка реакции).
Кислотно-основной катализ. При кислотно-основном катализе возникновение активного комплекса связано либо с переходом от катализатора протона к реагенту, либо с отдачей реагентом протона катализатору.
Механизм кислотно-основного катализа заключается в предварительном взаимодействии реагентов с кислотой или основанием (перенос протона), в результате чего образуется более реакционно-способное соединение по сравнению с исходным.
Окислительно-восстановительный катализ.При реакциях окислительно- восстановительного катализа образование активного комплекса связано с электронными переходами между катализатором и реагентом.
Металлокомплексный катализ. При металлокомплексном катализе в качестве катализатора используют комплексные соединения. Комплексные соединения катализируют реакции окисления (пирагаллола, аскорбиновой кислоты и др.), гидролиза, гидрирования, полимеризации и др. Комплексы могут вызывать цепные реакции окисления, в которых они являются инициаторами цепей.
Дата добавления: 2021-02-19; просмотров: 271;










