Пятичленные гетероциклы с одним гетероатомом. Кислотно-основные свойства атома азота на примере пиррола.
В пятичленных или небензоидных гетероциклах также образуется секстет делокализованных сопряженных p-электронов.
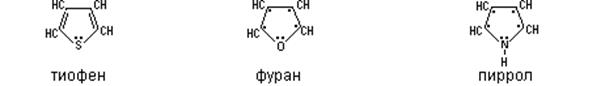
Каждая молекула гетероцикла – плоский пятиугольник. Рассмотрим электронное строение гетероциклов на примере пиррола.

Электроны азота под влиянием соседних связей располагаются также особым образом, а именно три электрона на sp2-гибридных орбиталях, участвуют в образовании трех s-связей (две расходуются на атомы углерода, а одна на водород). Негибридизованная p-орбиталь с неподеленной парой электронов входит в сопряженный ароматический секстет.
Так как шестиэлектронное облако приходится на пяти-центровую систему, то она называется суперароматической в отличии от шестичленных гетероциклов, а азот называется "пиррольным". За счет пиррольного азота гетероциклическая система приобретает слабокислотный характер, т.е. водород в –NH– группе может замещаться на металлы.
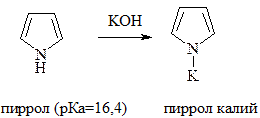
При действии кислот пиррол проявляет ацидофобные свойства, при этом происходит нарушение ароматических свойств и образование неустойчивой диеновой системы с последующей полимеризацией.

Вопрос 3. Химические свойства и строение пиррола, индола и их производных. Биороль порфинов.
В фуране и тиофене секстет образуют 4 электрона от атомов углерода, а два электрона являются свободной парой атома кислорода и серы, т.е. также являются суперароматической системой и фактически лишены кислотных свойств.
Фуран, подобно пирролу ацидофобен, протонирование под действием кислот происходит, по-видимому предпочтительно по углеродным атомам ядра.

Образующиеся таким образом сопряженные кислоты атакуют молекулу фурана, в результате чего происходит полимеризация. Тиофен по свойствам напоминает бензол, более устойчив по отношению к кислотам, а сера инертна к различным реагентам.
Гетероциклические соединения родоначального ряда (пиррол, фуран, тиофен и др.) в природе почти не встречаются, но их производные широко распространены и имеют очень важное биологическое значение. Многие из них синтезируются в процессе жизнедеятельности животных и растений. Строение этих соединений часто оказывается очень сложным и установление их структуры представляет одну из сложнейших задач для химиков-органиков и биохимиков. Рассмотрим некоторые природные соединения гетероциклического ряда, имеющих важное физиологическое значение.
Природные соединения пиррольного ряда
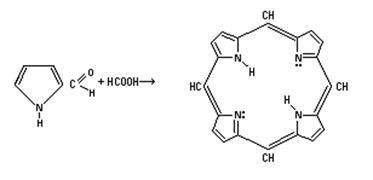
Важнейшим соединением названного ряда является порфин, молекула которого представляет собой сопряженную циклическую систему из четырех пиррольных колец. Это устойчивое соединение ароматического характера. Пиррольные колъца разделены метеновой =СН– группой в положениях 2 и 5.

Порфины в свободном виде в природе не встречаются, но их циклическая система найдена в ряде природных соединений, в частности: в гемоглобине, витамине В12, хлорофиле, цитохромах и т.д.
Впервые порфин был синтезирован Г.Фишером в 1929 году из пирролальдегида и муравьиной кислоты.
Порфины с углеродистыми заместителями называются порфиринами. Заместители, содержащие кратные связи, способны вступать в сопряжение с макроциклом и тем самым увеличивать делокализацию p-электронного облака в цикле, что придает таким соединениям большую устойчивость. Поэтому эти вещества представляют собой в основном тугоплавкие кристаллические вещества. Порфирины в природе находятся в виде комплексов с металлами. Комплекс с железом представляет собой простетическую группу важных гемопротеидов: гемоглобин, цитохромы, ферменты (каталаза, пероксидаза и др.). В молекулах этих веществ железо обычно двухвалентно и такие комплексы называются гемами. Железо имеет координационное число шесть. Четыре места занимают пиррольные кольца, пятое место занимает белок глобин, а шестое кислород. Комплекс с белком называется гемоглобином.

В цитохроме С строение гема такое же, но пятым лигандом является азот аминокислоты–гистидина, а шестым атомом серы аминокислоты-метионина. Комплекс кобальта с порфириновым циклом представляет собой витамин B12, пятым лигандом, в этом случае, является группа CN, шестым – атом азота бензимидазола.
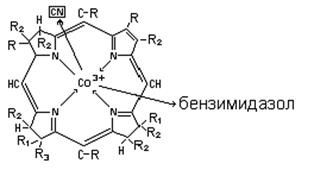
Витамин В12 (цианокобаламин) необходим для нормального кроветворения. Комплекс магния с порфирином – основа молекулы пигмента хлорофила, при участии которого растение ассимилирует углекислый газ из атмосферы, превращая его и воду в кислород и углеводы.
Индол – конденсированное гетероциклическое соединение состоящее из бензольного и пирролъного колец. По химическим свойствам напоминает пиррол (ацидофобен, проявляет слабокислотные свойства, вступает в реакции электрофильного замещения), но электрофильные реагенты в отличии от пиррола в основном вступают в b-положение или 3-положение.
Наиболее важное биологическое значение имеют такие вещества, производные индола, как триптофан, серотонин, индолилуксусная кислота и др.

Tpиптофан или α-амино-b(b’-индолил)уксусная кислота – "незаменимая aминокиcлoта", образующаяся при гниении белков. В зависимости от пути метаболизма триптофана в организме образуются разнообразные производные. Наиболее важное направление превращения триптофана – гидроксилирование с образованием серотонина.
Серотонин, или 5-окситриптамин – гормон, повышающий кровяное давление и вместе с тем регулирующий психическую деятельность. Предполагается, что серотонин является одним из нейромедиаторов головного мозга. Нарушение его нормального обмена в организме ведет к шизофрении. В норме серотонин окисляется в 5-гидрокси-b-ндолилуксусную кислоту и выводится с мочой.
Другой путь превращения триптофана происходит под влиянием гнилостных бактерий в кишечнике животных и человека. При этом образуется ядовитый триптамин, который при окислении дает b-индолилуксусную кислоту, называемую еще гетероауксином /ИУК/, последняя декарбоксилируется, превращаясь в 3-метилиндол или скатол. Скатол обладает неприятным запахом экскрементов. Общую схему превращения триптофана можно представить следующим образом:

Есть другие пути превращения триптофана, например, окислительный распад по связи C2-C3, приводящих к орто-аминофенолу, орто-аминобензойной кислоте и т.д.. Индольное кольцо входит также в состав так называемых галлюциногенов, при ввдении которых в организм человека происходит нарушение психической деятельности.
Так в мексиканских грибах семейства Psilocybe находится псилоцибин, вызывающий зрительные галюцинации,а из спорыньи злаковых получают диэтиламид лизергиновой кислоты, являющейся антагонистом серотонина. Синтетический лекарственный препарат индопан обладает антидепрессивным действием.

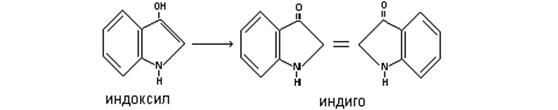
Индол входит также в состав синего красителя-индиго, полученного окислением индоксила, содержащегося в соке растения вида Indigotera.
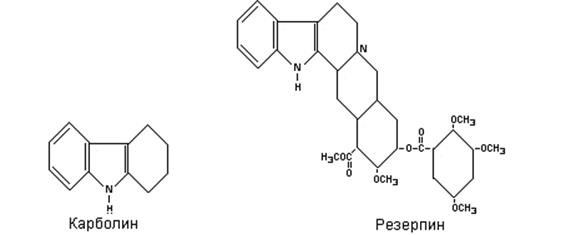
В основе алкалоидов Harmaja лежит линейная трициклическая структура, родственная одновременно индолу и пиридину: родоначальное соединение такого типа циклов носит название b-карболина. Сходное строение имеют более важные алкалоиды Iohimbe, из них наиболее важное значение имеет резерпин. Это соединение находит широкое применение при лечении гипертонической болезни, а также как успокаивающее средство (транквилизатор), действующий на центральную нервную систему. Транквилизирующее действие, по-видимому, обусловлено понижением концентрации серотонина в мозге.
Дата добавления: 2016-11-04; просмотров: 4804;











