ФИЗИКО-ХИМИЧЕСКИЕСВОЙСТВА ГРЕМУЧЕЙ РТУТИ
Гремучая ртуть получается в виде белых или серых блестящих шелковистых безводных кристаллов орто-ромбической (по Майльсу) системы (Рисунок 44). Уд. вес (по Бертло) 4,42. По Солонина, уд. вес очищенной в растворе цианистого калия белой гремучей ртути 4,394. Уд. вес гремучей ртути, очищенной перекристаллизацией из аммиака, по определению Майльса, равен 4,307 при 20°.
Причиной значительных расхождений между результатами определения уд. весов разными исследователями является неодинаковая чистота испытываемых образцов гремучей ртути.
Определение плотности гремучей ртути различной чистоты привело Патри к следующим результатам (см. таблицу).
| Содержание фульмината, % | Плотность |
| 99,7 99,0 98,0 97,0 | 4,32 4,36 4,38 4,40 |
Таким образом, чем менее чиста гремучая ртуть, тем больше ее удельный вес.
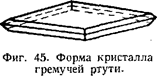
Форма кристалла гремучей ртути приведена на фиг. 45. Отношение осей кристаллов гремучей ртути a:b:c = 0,712 : 1 : 1,353; элементарная ячейка содержит 4 молекулы и характеризуется следующими параметрами: а = 5,87 Aнгстрем, b = 7,71 Ангстрем, с = 10,43 Ангстрем; объем ячейки равен 440,7 Ангстрем куб.; гравиметрическая плотность 1,22—1,25.
Гремучая ртуть имеет сладкий металлический вкус и, как почти все соединения, содержащие ртуть (за исключением киновари и каломели), ядовита.
Действие гремучей ртути на организм в основном сходно с действием металлической ртути и вызывает более или менее аналогичные симптомы отравления. Пыль гремучей ртути вызывает раздражение слизистых оболочек носа, гортани и глаз. При длительном и систематическом действии влажной гремучей ртути кожа раздражается. В тяжелых случаях заболевание напоминает мокнущую экзему.
Одним из основных условий предохранения от заболевания при работе с гремучей ртутью является строжайшее соблюдение условий производственной и личной гигиены и большая аккуратность в работе.
Гремучая ртуть практически не гигроскопична. Опыты определения гигроскопичности при различной относительной влажности дали следующие результаты:
| Относительная влажность, % | Время хранения, дни | Гигроскопическая влага |
| 0.02 0.02 0.16 |
Смеси гремучей ртути с ее обычными примесями обладают большой гигроскопичностью. Так, смесь ее с 20% каломели при 100% относительной влажности обладает гигроскопичностью 4,03%. При 50 и 80% относительной влажности эта смесь не гигроскопична. Гигроскопичность смеси гремучей ртути с хлоратом калия при 100% относительной влажности равна 30,11%. При 50 и 80% относительной влажности гигроскопичность соответственно равна 0,015—0,02%. Гумми-арабик также повышает гигроскопичность гремучей ртути. При наличии 8% гумми-арабика гигроскопичность возрастает и становится равной:
при 50% относительной влажности ..... 0,51%
» 80% » » ..... 0,81%
» 100% » » ..... 36,05%
Оксалат ртути, сопровождающий техническую гремучую ртуть, повышает ее гигроскопичность только при 100% относительной влажности.
Гремучая ртуть несколько растворима в воде. По Голлеману,
в 100 ч. воды растворяется:
при 12°С....... 0,07 г
» 49°С......... 0,175 г
» 100°С ......... 0,77 г
При длительном пребывании в водном растворе гремучая ртуть теряет свои взрывчатые свойства. При кипячении с водой она частично разлагается с образованием (по Либиху) окиси ртути, а затем (по Кекуле) — фульминуровокислой ртути и углекислоты.
Растворимостью в воде одно время пользовались для очистки гремучей ртути. Так, судя по отчету Яковлева, этот способ очистки применялся на заводе в Карлсруэ (Deutsche Waffen und Munitions Fabriken). Серую гремучуй ртуть просеивали и не проходящие через сита крупные кристаллы растворяли в кипящей воде; при охлаждении раствора осаждались мелкие шелковистые кристаллы желтоватого цвета. Опыты Шишкова и Гойтзема показали, что гремучая ртуть из воды кристаллизуется с 0,5 молекулы воды.
Применять воду в качестве растворителя для очистки гремучей ртути невыгодно. При очень медленном охлаждении раствора получают тонкие листочки разных форм, однако, это кристаллы одной системы. При быстром охлаждении водного раствора выпадают очень мелкие кристаллы той же системы.
Несколько лучше гремучая ртуть растворяется в спирте, значительно лучше — в водном аммиаке. По Штейнеру, водный раствор аммиака, подогретый до 30—35°, растворяет четырехкратное весовое количество ее. Однако указание Штейнера нам кажется несколько сомнительным.Растворимость гремучей ртути в аммиаке, по нашим опытам, значительно ниже. Для растворения 1 ч. гремучей ртути требуется около 30 ч. водного аммиака при 30°.
Аммиак с гремучей ртутью, повидимому, образует двойные соединения. Так, если быстро, при помешивании, внести чистую, мелкокристаллическую гремучую ртуть в раствор аммиака, то вначале происходит полное растворение продукта, а затем большая часть фульмината выделяется в виде соединения, теряющего на воздухе аммиак-Раствор в водном аммиаке бесцветен, но не долговечен. Уже через 5 дней замечается разложение, раствор темнеет и на стенке колбы появляется налет. Далее раствор разлагается окончательно с выделением закиси и окиси азота и металлической ртути. При нагревании до 60° раствор разлагается с образованием мочевины, гуанидина и т. п. Кристаллы, образующиеся посредством осаждения гремучей ртути выливанием аммиачного раствора в разведенную уксусную кислоту, большие, чисто белые, с содержанием фульмината 99,1—99,75%.
Способностью гремучей ртути растворяться в аммиаке иногда пользуются в лабораториях для ее очистки, принимая, конечно, меры против разложения. Приведем некоторые способы очистки гремучей ртути, предложенные Филиппом:
1. Белую гремучую ртуть растворяют в тридцатикратном количестве аммиака и оставляют на ночь. Выпавший желтый или красноватый осадок отфильтровывают, а фильтрат нейтрализуют уксусной кислотой. Через 2 часа гремучую ртуть отфильтровывают и высушивают. Выход 52,5%; чистота 98,70—99,93%.
2. Условия работы те же, только нейтрализацию производят концентрированной уксусной кислотой. При этом происходит значительное выделение тепла (до температуры кипения). Выход 72%; чистота несколько меньше (98,35—99,34%).
3. Белую гремучую ртуть растворяют, как описано выше, и быстро фильтруют. Затем нейтрализуют 30%-ной уксусной кислотой при охлаждении (температура не выше 35°). Выход 80%. Содержание фульмината 98,60—100,02%.
Стойкость гремучей ртути после перекристаллизации из аммиака значительно повышается. Так, помимо аналитических данных, приведенных выше, следует отметить, что при нагревании в течение 6 мес. при температуре 50—60° технический продукт потерял в весе 3,7%, г, то время как потеря в весе очищенной кристаллизацией из аммиака гремучей ртути оказалась равной 0,2%.
Хорошей растворимостью гремучей ртути в ацетоне, насыщенном аммиаком, пользуются при анализе ударных составов, содержащих гремучую ртуть.
Лангханс исследовал другие растворители (метиламин, хинолин и анилин), но их растворяющая способность оказалась незначительной.
А. Майрих обнаружил, что неплохими растворителями гремучей ртути являются моно-, ди- и триэтаноламины, причем лучшим растворителем является монопродукт. Так, 1 в. ч. чистого моноэтаноламина растворяет при 25° 2 в. ч. гремучей ртути. Растворимость падает с возрастанием гликолевых остатков в молекуле. Уже в 1 в. ч. диэтаноламина растворяется при 30° только 0,4 в. ч. гремучей ртути, а в I в. ч. триэтаноламина растворяется 0,27 в. ч. гремучей ртути.
Моноэтанрламин представляет собой бесцветную, несколько вязкую, уд. веса 1,22 при 16° жидкость с запахом аммиака, смешивающуюся с водой во всех отношениях. Безводный амин при стоянии на воздухе легко притягивает влагу, несколько летуч, легко испаряется при 100°. Примеси гремучей ртути в моноэтаноламине не растворяются. Насыщенный и отфильтрованный раствор гремучей ртути в моноэтаноламине (уд. вес 2,05) представляет собой густую жидкость, склонную при температурах выше 30° к очень бурному саморазложению, сопровождающемуся обильным выделением светлосерого дыма и вспученного темного продукта. Моноэтаноламин, как аммиак и другие амины, разлагает гремучую ртуть. Через 24 часа из раствора уже не удается выделить фульминат, так как образуются какие-то высокомолекулярные соединения. При разбавлении разложенного раствора водой он через некоторое время превращается в гель.
Смесь моноэтаноламина с концентрированным раствором аммиака растворяет гремучую ртуть в тем большей степени, чем больше амина находится в смеси. 1 ч. смеси из одинаковых объемов аммиака и моноэтаноламина растворяет 1,6 ч. гремучей ртути. Уд. вес раствора 1,7. Хотя растворимость гремучей ртути в этой смеси несколько меньше, чем в чистом амине, однако, применение ее более удобно, так как раствор лучше фильтруется и не склонен к внезапному разложению.
Чистота фульмината, высаженного немного разбавленной уксусной кислотой, 99,64; выход 85%.
Растворимость гремучей ртути в смеси моноэтаноламина и ацетона еще меньше: 1 в. ч. смеси из одинаковых объемов растворяет 0,85 в. ч. гремучей ртути.
Также хорошим растворителем для гремучей ртути является пиридин С5Н6N, предложенный для этой цели А. А. Солонина. В 100 мл пиридина растворяется 14,5 г гремучей ртути. При выпаривании раствора выпадают большие кристаллы соединения пиридина с гремучей ртутью, теряющие пиридин при обработке водой или при высушивании и распадающиеся. Пиридиновый раствор более стоек, чем аммиачный, но и он с течением времени разлагается. При длительном же нагревании гремучей ртути с пиридином происходит полное разложение с сильным окрашиванием раствора. Следует отметить, что растворение гремучей ртути в пиридине сопровождается разогреванием раствора; например, при размешивании 2,6 г сухой Hg(ONC)2 в 18 мл пиридина температура раствора поднимается на 6,5°.
Гремучую ртуть можно осадить из пиридинового раствора и водой. Изготовленный в указанной выше пропорции светложелтый раствор гремучей ртути в пиридине отфильтровывают и приливают к воде, взятой в отношении 100 мл на 1 г гремучей ртути. Выделяющиеся кристаллы промывают после фильтрования водой из расчета 200 мл на 1 г гремучей ртути. Выход гремучей ртути около 80%, содержание фульмината 99,7%.
Водный раствор цианида калия хорошо растворяет гремучую ртуть с образованием двойной соли: Hg(ONC)2KCN В концентрированном водном растворе цианида калия растворяется приблизительно двойное количество гремучей ртути. Последняя кристаллизуется вместе с KCN; поэтому выделение из раствора цианида калия затруднительно без дополнительной промывки разбавленной HNО3. Методика перекристаллизации гремучей ртути из водного раствора цианида калия была впервые разработана Штейнером еще в 1876 г. Из раствора гремучую ртуть можно также выделить кислотами, лучше всего разбавленной азотной кислотой (Григорович, Броунсдон и Солонина). Однако гремучая ртуть, кристаллизованная из кислот, менее чиста, чем кристаллизованная из аммиачного раствора. Лей и Киссель пользовались для выделения гремучей ртути слабой серной кислотой, что, конечно, небезопасно. При пользовании разведенной уксусной кислотой фульминат получается в виде достаточно крупных кристаллов без наростов и после сушки обладает хорошей сыпучестью.
Водный раствор роданида калия также растворяет гремучую ртуть. Хорошо растворяет гремучую ртуть водный раствор иодида калия, но он почти моментально ее разлагает. Водный раствор тиосульфата натрия растворяет ее с более медленным разложением. Оба эти раствора становятся щелочными, и это используется для объемного метода определения фульмината в гремучей ртути.
Таким образом ни один из описанных выше растворителей не пригоден для целей промышленной кристаллизации гремучей ртути, а стало быть, для очистки ее: либо растворитель разлагает гремучую ртуть или образует с нею комплексные соединения, либо практическое осуществление совершенно невыгодно (вода).
Разбавленные кислоты не разлагают гремучую ртуть. Разбавленная азотная кислота растворяет ее, причем растворимость растет с увеличением концентрации кислоты. Из азотнокислого раствора гремучая ртуть может быть осаждена выливанием раствора в холодную воду. При этом кристаллы получаются очень мелкими и такой же чистоты, как осажденные из раствора. При нагревании же азотнокислого раствора гремучей ртути последняя разлагается с образованием нитрата ртути и углекислоты.
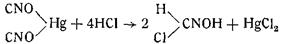
который в свою очередь разлагается с образованием хлоргидрата гидроксиламина и муравьиной кислоты (Карстаньен и Эренберг);
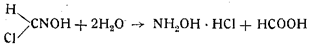
Концентрированные кислоты разлагают гремучую ртуть. Так, дымящаяся азотная кислота разлагает ее с образованием углекислоты, окислов азота, уксусной кислоты и азотнокислой ртути. Концентрированная серная кислота вызывает взрыв. При действии концентрированной соляной кислоты получается вначале, как установил Шолль, формилхлоридоксим:
Результативную реакцию можно написать следующим образом:
Hg(ONC)2 + 4HCl+4Н20 = 2NH2OH×HCl+2HCOOH-f-HgCI2
Сероводород и сернистые щелочи разлагают гремучую ртуть с образованием сернистой ртути; в первом случае, по данным Камби, кроме того, образуется формотиогидроксаловая кислота:
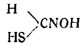
Углекислота на гремучую ртуть практически не действует. Хлор разлагает влажную гремучую ртуть, образуя хлорциан, хлорпикрин и хлористую ртуть.
Сильными щелочами гремучая ртуть разлагается легко, а слабые щелочи действуют на нее медленно. Для уничтожения небольших количеств фульмината ртути можно рекомендовать пользование крепкими щелочами. Анилин взаимодействует с гремучей ртутью с образованием металлической ртути, фенилмочевины и дифенилгуанидина. С гомологами анилина реакция идет лишь при нагревании.
Интересная реакция, указывающая на родство гремучей кислоты с синильной кислотой, происходит при действии гремучей ртути на бензол в присутствии хлористого алюминия, содержащего следы воды. Реакция идет с образованием бензальдоксима:
C6H6 + C=NOH -> C6H5CH(NOH)
При применении безводного хлористого алюминия образуется нитрил бензойной кислоты, — несомненно, как продукт ангидризации первоначально образовавшегося бензальдоксима:
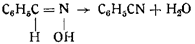
К различным металлам гремучая ртуть относится различно. Этот вопрос является чрезвычайно важным, так как гремучая ртуть всегда применяется впрессованной в металлическую оболочку.
Впервые упоминают о взаимодействии гремучей ртути с металлами Гладстон, Уаррен и Чельцов. Наиболее полно этот вопрос исследовали Солонина, Гедымин и др.
Упоминания первых исследователей о взаимодействии гремучей ртути с медью не были подтверждены достаточными экспериментами. Чельцов, например, указывает, что порошкообразная медь при нагревании с водой и гремучей ртутью замещает ртуть, которая выделяется в свободном состоянии по уравнению:
Hg(ONC)2 + Cu -> Cu(ONC)2 + Hg
В начале 90-х годов прошлого столетия Уаррен, действуя на медные стружки горячим водным раствором гремучего серебра, получил один из фульминатов меди. Раствор последнего он разлагал электролитическим методом и выделял медь. Однако новых фульминатов он в чистом виде, невидимому, не получал и их свойств не исследовал. При взаимодействии гремучей ртути с медью в присутствии воды (по Солонина) образуется смесь гремучей меди, гидрата окиси меди и углекислой меди:
nCu(ONC)2 • mCu(OH)2 • pCuCO3
где n = 98 (приблизительно), а m и р вначале не более 2—3, а затем увеличиваются. Это соединение нестойкое и разлагается даже при комнатной температуре, особенно в присутствии воды. Образованию его благоприятствуют металлическая ртуть и вода, обычно находящиеся в качестве примеси в техническом продукте. Сухая гремучая ртуть при обыкновенной температуре почти не реагирует с металлами.
Исследования Паникова и Сухова показали, что при взаимодействии меди с гремучей ртутью образуется химически стойкий основной фульминат меди состава Cu(ONC)2Cu(OH)2, обладающий пониженной чувствительностью к удару и нагреву, но зато резко повышенной чувствительностью к трению. Для образования основного фульмината необходимо обязательное присутствие влаги. В безводной среде (толуол) он не образуется.
Если внести 3 г гремучей ртути и 6 г медных опилок, очищенных от железа магнитом и обезжиренных эфиром, в колбочку с 30 мл дестиллированной воды и оставить в термостате при 30°, то уже через сутки вода в колбочках окрашивается в зеленый цвет, а на поверхности ее появляется тонкий слой зеленого вещества. Если эти колбочки выдержать в термостате при 30º до 30 суток без взбалтывания, затем снять образовавшуюся на поверхности зеленую корочку, высушить ее при 45° в продолжение 1—2 час. в эксикаторе над хлористым кальцием, то окажется, что полученное вещество содержит:
| Через 5 суток | Cu(ONC)2Cu(OH)2 – 77.3% СuCO3·Cu(OH)2 – 22.7% |
| Через 10 суток | Cu(ONC)2Cu(OH)2 – 83.5% СuCO3·Cu(OH)2 – 16.5% |
| Через 15 суток | Cu(ONC)2Cu(OH)2 – 81.4% СuCO3·Cu(OH)2 – 18.6% |
| Через 20 суток | Cu(ONC)2Cu(OH)2 – 74.8% СuCO3·Cu(OH)2 – 25.2% |
Если снарядить смоченные внутри водой оболочки капсюлей-детонаторов сухой гремучей ртутью и хранить их при обыкновенной температуре, то уже через 96 час. повысится чувствительность гремучей ртути к трению, что было установлено опытами на массете.
Исследование капсюлей-детонаторов, хранившихся в течение 16—18 лет в обычных условиях (изготовления 1914—1916 гг.), подтвердило возможность образования основного фульмината меди. Так, например, в одном из капсюлей, снаряженном в 1916 г. и находившемся до 1928 г. во взрывателе, ввернутом в снаряд, а затем в неотапливаемом помещении до 1932 г., гремучая ртуть по наружному виду в изломе оказалась зеленого цвета с падающей интенсивностью позеленения от стенок латунной гильзы к центру. При разрядке капсюля было обнаружено, что гремучая ртуть на всем протяжении гильзы имеет зеленый цвет, а латунная оболочка в месте соприкосновения ее с гремучей ртутью значительно амальгамирована и настолько разрушена, что при разрядке взрывателя капсюль дал излом в месте нахождения гремучертутного заряда. Исследование извлеченной из капсюля гремучей ртути показало содержание в ней меди около 6—6,1%; чувствительность к трению оказалась значительно выше, чем у гремучей ртути.
Все эти опыты позволяют сделать следующие выводы:
1) в условиях негерметического хранения гремуче ртутного капсюля-детонатора в медной или латунной оболочке гремучая ртуть взаимодействует в присутствии влаги с оболочкой, образуется основной фульминат меди и происходит обильное выделение металлической ртути;
2) гремучая ртуть благодаря образованию основного фульмината меди становится значительно более чувствительной к трению.
Так как гремучая ртуть применяется исключительно в оболочках из меди или ее сплавов (латунь или мельхиор), то естественно, что вопросу изучения взаимодействия меди и гремучей ртути уделяется большое внимание. Не меньшее внимание уделяется изучению возможности замены меди и ее сплавов в капсюлях-детонаторах или защите тем или иным способом оболочки от действия ртути.
С магнием гремучая ртуть вступает в бурное взаимодействие со значительным выделением тепла даже при небольшом количестве воды. При этом выделяется аммиак и образуется невзрывчатое, растворимое в воде, магниевое соединение.
С алюминием влажная гремучая ртуть реагирует очень бурно, с образованием объемистой массы, состоящей, главным образом, из окиси алюминия, гремучей ртути и металлической ртути. При реакции, в начале ее, обычно появляется запах синильной кислоты.
С цинком влажная гремучая ртуть реагирует медленнее. Причем образующийся при этом фульминат цинка взрывает не хуже гремучей ртути. Е. Деви показал, что при действии 1 ч. Hg(ONC)2 на 2 ч. цинка на холоду в присутствии воды образуется гремучий цинкг кристаллизующийся в виде ромбических таблеток. Со временем под действием воды фульминат цинка разлагается и переходит в гидрат окиси цинка.
На никель ни влажная, ни сухая гремучая ртуть не действуют. На олово сухая гремучая ртуть не действует.
Техническая же гремучая ртуть в присутствии влаги действует на олово, поверхность которого покрывается матовыми серыми пятнами, невидимому, представляющими собой амальгаму олова. Действие это незначительно и увеличивается с увеличением в технической гремучей ртути примеси металлической ртути и ее закисных соединений.
Со свинцом гремучая ртуть взаимодействует слабо; это нисколько не сказывается на технических свойствах металла. Повидимому, поверхностный слой свинца образует с имеющейся во влажной технической гремучей ртути металлической ртутью амальгаму. Затем свинец вытесняет из гремучей ртути металлическую ртуть и образует фульминат свинца, который гидролизуется водой с образованием нерастворимых основных солей свинца, покрывающих поверхностной защитной пленкой основную массу свинца, вследствие чего прекращается дальнейшее взаимодействие металла с гремучей ртутью.
Гремучая ртуть при обыкновенной (комнатной) температуре весьма устойчива. При нагревании гремучей ртути до температуры вспышки разложение ее ускоряется по мере возрастания температуры. Продолжительное нагревание гремучей ртути при температуре 50° и выше вызывает ее разложение. При этом следует отметить, что разложению подвергаются в первую очередь примеси гремучей ртути. Наиболее быстрое разложение без взрыва наблюдали Гесс и Дитль при нагревании до 90—95°, причем через 35—50 час. гремучая ртуть значительно потеряла свои взрывчатые свойства, а после 75—100 час. превратилась в коричнево-желтый-трудно воспламеняющийся порошок.
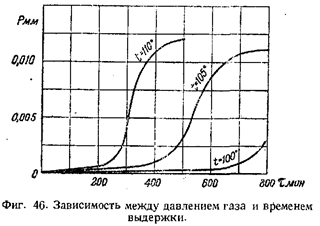
Фармер исследовал превращения чистой гремучей ртути при нагревании в интервале 60—100°. Он показал, что разложение происходит тем быстрее, чем выше температура, и что выделяющиеся газообразные продукты разложения состоят почти исключительно из двуокиси углерода.
При разложении гремучей ртути наблюдается отчетливый индукционный период, при котором выделение газа очень мало. Продолжительность индукционного периода зависит от качества гремучей ртути. Так, например, обыкновенная серая гремучая ртуть при 80° имеет индукционный период продолжительностью около 80 час. Белая гремучая ртуть имеет больший индукционный период. В конце индукционного периода кристаллы Hg(ONC)2 разламываются и окрашиваются, далее наступает период заметного ускорения разложения, кристаллы становятся совершенно коричневыми. Затем скорость разложения остается постоянной.
Поведение белой и серой гремучей ртути и в послеиндукционном периоде различно. Разложение белой гремучей ртути происходит с большим ускорением и конечная скорость ее разложения больше, чем у серой гремучей ртути.
На фиг. 46 изображены кривые разложения по данным измерений давления выделяющихся при разложении 0,002 г гремучей ртути газов (по данным В. Е. Гарнера и.Х. Р. Хильса) при температурах 100°, 105° и 110°.
Лангханс исследовал коричнево-желтый трудно воспламеняющийся порошок, получающийся в результате нагревания гремучей ртути в течение 72 час. при температуре 82°, и нашел в нем содержание ртути 76,4% вместо 70,4%.. Он установил, что увеличение содержания ртути в порошке пропорционально времени нагревания.
При температурах выше 100° гремучая ртуть может взрывать. Однако, по данным Гойтзема, можно разлагать гремучую ртуть при осторожном и медленном нагревании до 132°.
Опыты Солонина показали, что при нагревании гремучей ртути при постоянных температурах получение вспышки в значительной степени зависит от качества (в первую очередь от чистоты) продукта.
Нагревание при 134—135° белой гремучей ртути, очищенной кристаллизацией из раствора цианистого калия, вызывает вспышку обычно через 36—40мин., а серая гремучая ртуть с содержанием 0,4% металлической ртути и 0,7% щавелевой кислоты дает вспышку через 20— 22 мин. При нагревании при 126,5° очищенный кристаллизацией из раствора цианистого калия белый продукт взрывает через 1 ч. 14 м.— 1 ч. 16 м. Серая гремучая ртуть при этих условиях не взрывает, даже при нагревании ее в течение 12 час.
Патри и Лаффит показали, что при температурах ниже 139,5° не происходит воспламенения, но процесс выделения газов значительно ускоряется.
Осторожно нагреваемая и разлагающаяся вследствие этого гремучая ртуть становится менее чувствительной к удару. Так, например, при нагревании гремучей ртути при 133°:
а) от 0 до 20 мин. — при ударе еще происходит детонация;
б) от 20 до 50 мин. — характер взрыва указывает на уменьшение силы гремучей ртути;
в) от 50 до 80 мин. — продукт горит, но не детонирует от удара;
г) свыше 80 мин. — образуется продукт нечувствительный к удару;
д) свыше 100 мин. — продукт даже не воспламеняется от луча огня.
Таблица 13
| Давление | Время выделения газов, часы. При 60º (Один грамм гремучей ртути) | |||||
| 1 см куб | 2 см куб | 3 см куб | 4 см куб | 5 см куб | 6 см куб | |
| Вакуум Вакуум Вакуум 500 мм рт ст | - |
Фармер, разлагая гремучую ртуть при 60° в вакууме (остаточное давление 5 ммрт. ст.), доказал, что давление мало влияет на скорость разложения.
Выделение газов происходит в вакууме несколько быстрее, чем под давлением 500 мм рт. ст., что видно из табл. 13.
Патри и Лаффит установили, что при нагревании между 139 и 172° обнаруживается критическое давление Рс, ниже которого взрыв уже более невозможен. Это давление всегда ниже 45 мм рт. ст. и уменьшается при повышении температуры, как это видно из табл. 14.
Время задержки взрыва гремучей ртути при нагревании не зависит от давления только в том случае, если сравниваемое давление выше критического.
Таблица 14
| Температура, С | ||||
| Давление, Р | 0.2 |
При температуре выше 172° взрывы происходят вне зависимости от давления.
При обычной температуре гремучая ртуть может храниться в сухом состоянии в течение длительного времени. Считают, что она практически не претерпевает при. этом никаких изменений в своих свойствах. Свет также оказывает некоторое влияние на гремучую ртуть, вызывая отчетливое выделение газа. Фармер установил, что белый и серый продукты, хранившиеся на свету, выделили следующее количество газа в миллилитрах (табл. 15):
Таблица 15
| Время хранения в часах | ||||
| Белая гремучая ртуть – 3 гр Серая гремучая ртуть – 3 гр | 0.11 0.04 | 0.23 0.08 | 0.30 0.11 | 0.37 0.14 |
Как только препараты помещались в темноту, выделение газа
прекращалось. У образцов, подвергнутых действию дневного света
в продолжение пяти недель в летнюю ясную погоду, ckopocть выделения газа при последующем нагревании при 80° повысилась.
Гремучая ртуть, освещаемая в течение продолжительного времени солнечным светом, окрашивается в слегка желтоватый цвет без видимого изменения остальных свойств. Будучи подвергнута действию ультрафиолетовых лучей, она по прошествии нескольких часов принимает коричнево-черную окраску (независимо от начального цвета продукта).
Патри и Лаффит после месячной экспозиции с ежедневным тщательным перемешиванием массы гремучей ртути получили почти черный продукт, в котором анализом было установлено содержание ртути, равное содержанию ее в исходном продукте. Повидимому, под влиянием ультрафиолетовых лучей происходит изомеризация или полимеризация с сохранением той же кристаллической формы.
Полученный продукт растворим в водном растворе гипосульфита со щелочной реакцией и в водном растворе цианистого калия, но в противоположность гремучей ртути не вполне растворяется в аммиаке. Этот продукт легче воспламеняется, чем чистый фульминат. Чувствительность к удару облучаемой ультрафиолетовыми лучами гремучей ртути убывает. При облучении свыше месяца гремучая ртуть становится совершенно нечувствительной к удару.
Дата добавления: 2021-02-19; просмотров: 147;










