Уравнение состояния идеального газа
Одним из первых достижений молекулярной физики является создание теории идеальных газов. Если взаимодействием между молекулами можно пренебречь, то газ называется идеальным Близок к идеальному реальный газ при низких температурах, невысоких давлениях и малой концентрации частиц.
Состояние идеального газа можно описать с помощью трех параметров: давления, абсолютной температуры и объема. Эти характеристики являются результатом усреднения по большому числу частиц системы. Давление измеряется в Паскалях: 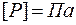 , абсолютная температура измеряется в Кельвинах:
, абсолютная температура измеряется в Кельвинах: 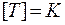 , размерность объема:
, размерность объема: 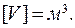
Уравнение состояния идеального газа
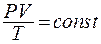 (8.1)
(8.1)
Для 1 моля вещества, 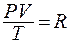 где
где 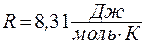 - универсальная газовая постоянная.
- универсальная газовая постоянная.
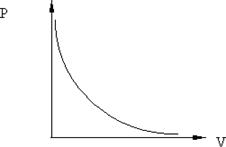
Рис. 8.1.
Запишем газовые законы для изопроцессов, происходящих при условии, что один из параметров: температура 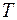 , давление P или объём
, давление P или объём 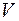 остаются постоянными.
остаются постоянными.
Закон Бойля-Мариотта (изотермический процесс:T = const, m = const): При неизменных температуре и массе произведение численных значений давления и объёма газа постоянно:
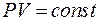 (8.2)
(8.2)
или для двух состояний газа:
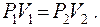
График изотермы на диаграмме 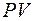 приведён на рис. 8.1.
приведён на рис. 8.1.
Закон Гей – Люссака (изобарный процесс: 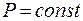 ,
, 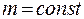 ): При постоянном давлении объём данной массы газа прямо пропорционален его абсолютной температуре:
): При постоянном давлении объём данной массы газа прямо пропорционален его абсолютной температуре:
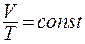 (8.3)
(8.3)
или для двух различных состояний:
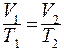 .
.
График изобары на диаграмме 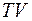 приведён на рис. 8.2.
приведён на рис. 8.2.
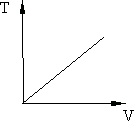
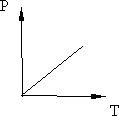
Рис. 8.2. Рис. 8.3.
Закон Шарля (изохорный процесс: V = const, m = const): При постоянном объёме давление данной массы газа прямо пропорционально его абсолютной температуре:
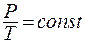 (8.4)
(8.4)
или для двух состояний:
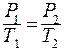 .
.
График изохоры на диаграмме РТ приведён на рис. 8.3.
Уравнение состояния идеального газа для произвольного количества вещества называется уравнением Менделеева - Клапейрона:
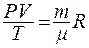 (8.5)
(8.5)
Найдём число молекул, содержащихся в единице объёма идеального газа. Запишем уравнение Менделеева – Клапейрона в виде: 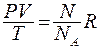 , откуда находим:
, откуда находим:
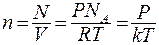 (8.6)
(8.6)
где 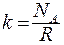 - постоянная Больцмана:
- постоянная Больцмана: 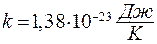 .
.
Менделеев Дмитрий Иванович (1834 - 1907), русский учёный, родился в Тобольске. Окончил Главный педагогический институт в Петербурге. Открыл в 1862 г. один из фундаментальных законов природы - периодический закон химических элементов, нашёл общее уравнение состояния идеального газа (уравнение Менделеева-Клапейрона). Сконструировал барометр. В 1888 г. выдвинул идею подземной газификации угля.
Клапейрон Бенуа Поль Эмиль (1799 - 1864), французский физик и инженер, родился в Париже. Окончил Политехническую школу. Физические исследования посвящены теплоте, пластичности и равновесию твёрдых тел. Ввёл в термодинамику метод диаграмм, в частности, предложил систему координат  . В 1834 г. вывел уравнение состояния идеального газа и уравнение, устанавливающее связь между температурой плавления и кипения вещества и давлением - уравнение Клапейрона - Клаузиуса.
. В 1834 г. вывел уравнение состояния идеального газа и уравнение, устанавливающее связь между температурой плавления и кипения вещества и давлением - уравнение Клапейрона - Клаузиуса.
Для смеси идеальных газов выполняется закон Дальтона:
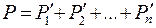 (8.7)
(8.7)
где 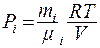 - парциальное давление компонентов смеси;
- парциальное давление компонентов смеси; 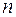 - число компонентов смеси;
- число компонентов смеси; 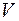 ,
, 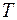 - установившиеся объем и температура смеси газов.
- установившиеся объем и температура смеси газов.
Парциальным давлением i-го компонента смеси называется давление газа при условии, что установившийся объем заполнен только этим компонентом и температура равна температуре смеси.
Количество вещества смеси газов:
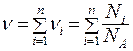 ,
,
или
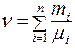 (8.8)
(8.8)
где 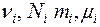 - количество вещества, число молекул, масса и молярная масса i-го компонента смеси, соответственно.
- количество вещества, число молекул, масса и молярная масса i-го компонента смеси, соответственно.
Молярная масса смеси газов:
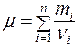 (8.9)
(8.9)
Дата добавления: 2019-09-30; просмотров: 412;










