Кристаллические структуры, двойные соли, смешанные кристаллы
Все кристаллические решётки в системе CaSO4 - H2O состоят из CaSO4 -слоёв, между которыми в зависимости от фазы встроено различное количество воды. Структура слоя оказывает влияние на относительно лёгкую расщепляемость гипсового камня параллельно с (010)-площадью. При фазовых преобразованиях CaSO4 -слои остаются ненарушенными. Таблица 1.28 содержит кристаллографические параметры важных фаз в системе CaSO4 - H2O.
Кристаллическая структура дигидрата представлена на рисунке 1.57.CaSO4-слои состоят из 1 ∞ {SO4 -Ca-SO4 -Ca}-цепочек, при этом тетраэдры ионов сульфата при помощи атомов кислорода увязаны с каждым из двух Са-катионов. Эти слои связаны между собой водородными мостиковыми соединениями (длина 2,816 и 2,896 Å) между Н-атомами воды и О-атомами анионов сульфата. При этом молекула воды с помощью одного Са2--иона и одного сульфат-О-атома увязывает один слой, а также слой, соседний с сульфат-О-атомом. Такое расположение объясняет относительно лёгкую отдачу воды у дигидрата, которая начинается уже с 42 0С. При удалении воды в первую очередь необратимо возникает CaSO4·0,6H2O (так называемый «субгидрат»), который при дальнейшей отдаче воды, в соответствии с уравнением 29,обратимо превращается в полугидрат CaSO4 · 0,5H2O. Из него благодаря дальнейшей подаче энергии образуется ангидрит III (γ-CaSO4), который имеет такую же примерно решётчатую структуру, как и полугидрат. Ангидрит II образуется из ангидрита III при отдаче энергии. Ангидрит II имеет самое плотное ионное окружение и относительно слабую способность вступать в реакцию с водой [184, 192, 180].
CaSO4·2H2O 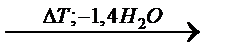 CaSO4·0,6H2O
CaSO4·0,6H2O 
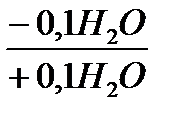
 CaSO4·0,5H2O
CaSO4·0,5H2O 
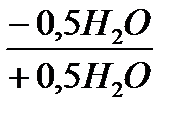
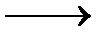 γ-CaSO4 Уравнение 29
γ-CaSO4 Уравнение 29
Во всех фазах цепочки Ca-SO4-Са проходят через структуру в кристаллографическом [001]-направлении. Эти цепочки расположены гексагонально и в центрах шестиугольников образуют проходимые каналы, которые могут быть заняты водой. Кристаллическая структура α-полугидрата (бассанита) показана на рисунке 1.58. По сравнению с дигидратом, бросаются в глаза относительно большие цеолитные каналы. У γ-CaSO4, который содержит 0-0,03 молей воды, эти каналы практически не заняты.
При удалении воды из кристаллов воды сохраняется не только основное решётчатое строение; даже сама кристаллическая форма практически не изменяется [181]. Кристаллизационная вода уходит через разрывы на поверхности кристалла (см. рисунок 1.59). Конечно же, с такой потерей воды связано и заметное увеличение плотности (смотри таблицу 1.28).

Рисунок 1.57-Кристаллическая структура дигидрата кальциевого сульфата [192]

Рисунок 1.58-Кристаллическая структура α-полугидрата (бассанита) [192]

Рисунок 1.59 - Удаление воды из гипса: исходный материал CaSO4 - дигидрат (слева); образованный с помощью дегидратации ß-полугидрат (справа)
Гипс кристаллизуется часто пластинчато-плоским, при этом часто доминирует (010)-поверхность. Рисунок 1.60 показывает типичные морфологии дигидратных кристаллов, которые редко встречаются в природе. В продуктах строительных материалов морфологии и размеры кристаллических решёток влияют на условия гидратации (соотношение вода/гипс и процесс сушки), а также на возможные побочные вещества (соли или же такие строительно-химические добавки, как например замедлители или разжижители). Под микроскопом часто можно увидеть игольчатые или плотные кристаллы с характерным «гипсовым углом» (см. рисунок 1.61). Гипсовый строительный материал должен под микроскопом показывать сочетание сильного срастания и овойлачиваемости дигидратных кристаллов.
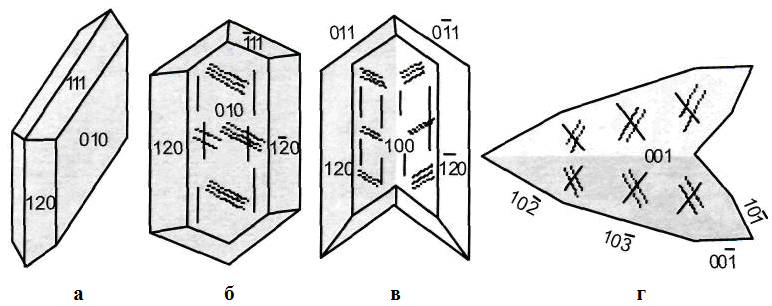
Рисунок 1.60-Морфология гипса: a) пластинчатый монокристалл; б) кристалл, вытянутый по с-оси; в) так называемый двойниковый кристалл «ласточкин хвост»; г) так называемый двойниковый кристалл «Монмартр» [182]

Рисунок 1.61-Типичные формы проявления гипсовых кристаллов в строительных материалах: игольчато вытянутый (слева) или же плотный габитус (облик) (справа)
Гипс образует двойные и тройные соли и смешанные кристаллы. Большое значение имеют двойная соль сингенит CaSO4·К2SO4·2H2O (продукт гидратации при затвердевании с помощью К2SO4 активированного ангидрита - см. 1.3.5; промежуточного продукта при гидратации цемента - см. 1.1.10.4), а также тройная соль полигалит 2CaSO4 · MgSO4 · K2SO4 · 2H2O, который встречается в месторождениях соли. Большое значение в химии цемента имеет эттрингит 3CaO · Al2O3 · 3CaSO4 · 32H2O (сравни 1.1.10.2). В химических гипсах широко распространена изоморфия с соединениями из реакционной среды. Так, например, в гипсе, как побочном продукте при производстве сырой фосфорной кислоты (далее кратко называемом фосфогипс) CaHPO4* ·H2O, NaH2PO4 или AIF52- встроены в решётку гипса изоморфно. Na+ до 0,02 % присоединяется к решётке гипса и до 0,2 % к решётке полугидрата. Хлориды ни как двойная соль, ни изоморфно не встраиваются в решётку сульфата кальция. Этот эффект препятствует большей частью нежелательному концентрированию хлорида, как побочного продукта при десульфитизации дымовых газов, а также при так называемом «аридизировании» полугидрата (обработка раствором хлорида кальция с целью старения и усреднения).
На растворимость сульфата кальция и его гидратов в воде и в кислотах сильно влияют сопровождающие ионы. При выпаривании солевых растворов, содержащих сульфат кальция, часто наступает нежелательное образование гипсовой корки.
Дата добавления: 2016-10-26; просмотров: 2601;










